Détection de la protéine Snail dans un embryon de Drosophile vivant
Rouge: Noyaux (Histone-RFP)
Vert: Protéines Snail (Sna-LlamaTag)
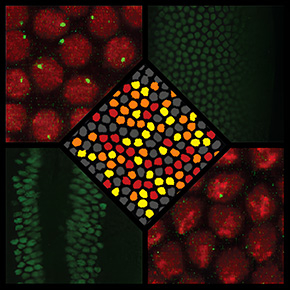
Le développement embryonnaire ne requiert pas uniquement l’activation des gènes, mais également une régulation fine de leur répression. Dans une étude publiée dans Nature Communications, des scientifiques utilisent l’embryon de drosophile pour démontrer que la répression de l’expression des gènes est un mécanisme beaucoup plus complexe qu’attendu.
On compare souvent les gènes à des interrupteurs : allumés, ils produisent des ARNs ; éteints, ils ne s’expriment plus. Mais la réalité est plus subtile. Pour qu’une cellule adopte une identité précise (peau, muscle, neurone…) il faut non seulement activer certains gènes, mais aussi réprimer activement d’autres, et ce de manière réversible. Sans ce silence imposé transitoirement, le programme génétique s’embrouille, compromettant la construction d’un organisme fonctionnel.
La répression joue donc le rôle d’un frein de sécurité. Contrairement à une mise hors service définitive, elle est rapide, réversible et modulable : idéale pour les décisions rapides qui jalonnent le développement embryonnaire.
Pour décortiquer ce mécanisme, les scientifiques se sont tournés vers la drosophile, un organisme modèle précieux. Leur cible : le gène snail, connu pour son rôle dans une étape clé appelée transition épithélio-mésenchymateuse (EMT)
Durant l’EMT, des cellules changent radicalement de comportement : elles perdent leur organisation collective pour devenir mobiles et former de nouveaux tissus. Ce processus est indispensable à l’embryon, mais il est aussi détourné par des cellules cancéreuses pour migrer et envahir l’organisme.
Le gène snail code pour une protéine qui agit comme répresseur, la protéine Snail. Dans une étude publiée dans la revue Nature Communications, des scientifiques ont suivi son action en temps réel, grâce à de la microscopie à fluorescence et à des modèles mathématiques. Ils ont observé que Snail ne se contente pas d’éteindre un gène : il modifie complètement la dynamique de son activité.
Traditionnellement, on décrivait l’activité d’un gène comme une alternance entre deux états : ON (actif) et OFF (inactif). Mais l’étude révèle que la répression introduit un troisième état OFF beaucoup plus long et stable.
Concrètement, cela signifie qu’un gène ne se contente pas d’être mis en pause brièvement : il peut être verrouillé dans un silence durable, empêchant ainsi la cellule de réactiver un programme inapproprié au mauvais moment.
La succession de ces états n’est pas entièrement prévisible, elle obéit au hasard, ce qui engendre une variabilité naturelle dans l’expression des gènes, appelée bruit intrinsèque. Ce bruit introduit une limite fondamentale à la précision avec laquelle les cellules peuvent contrôler leur développement.
Trouver le nombre et la durée de ces états est donc essentiel pour pouvoir prédire, de façon quantitative, l’impact de ce bruit et ses conséquences sur les processus biologiques.
La coopérativité est un ancien concept en biophysique. En 1904 Christian Bohr découvre que l’hémoglobine ne lie pas l’oxygène de façon linéaire et que la fixation d’une molécule d’oxygène facilite celle des suivantes. En 1910, Archibald Hill propose une loi empirique connue sous le nom de la loi de Hill qui explique la courbe sigmoïde de saturation de l’oxygène.
De manière similaire, chez l’embryon de drosophile, la protéine Snail induit une réponse très abrupte, bien représentée par la loi de Hill : une petite variation de sa concentration suffit à entraîner un basculement net de l’expression du gène cible. Si la coopérativité de l’hémoglobine permet la libération ou fixation rapide de l’oxygène en fonction des conditions physiologiques, celle de Snail assure que toutes les cellules d’un tissu embryonnaire évoluent de manière coordonnée.
« En combinant des approches de génétique, biologie moléculaire et imagerie quantitative d’échantillons vivants, nous avons pu décortiquer ce mécanisme » précise Mounia Lagha, co-responsable de l’étude. « La coopérativité de la protéine Snail semble surtout inscrite dans une séquence régulatrice de l’ADN où neuf sites de fixation rapprochés permettent à plusieurs molécules de la protéine Snail d’agir ensemble. Ce travail collectif stabiliserait la répression et prolongerait les périodes d’inactivité transcriptionnelle. »
Cette étude illustre parfaitement la rencontre entre biologie expérimentale et modélisation mathématique.
« La modélisation mathématique permet de simplifier la réalité pour tester des prédictions à partir de données concrètes. En combinant expériences et calcul, les scientifiques ont décrit comment la répression se met en place dans un tissu entier et se coordonne entre les cellules » précise Ovidiu Radulescu, co-responsable de l’étude.
Cette approche quantitative marque une avancée majeure : elle permet d’aller au-delà d’une description qualitative (« le gène est réprimé ») pour quantifier précisément la durée, la force et la dynamique du silence imposé. La modélisation a aussi permis aux chercheurs de faire des prédictions : lorsque la coopérativité faiblit, l’expression génétique est moins coordonnée.
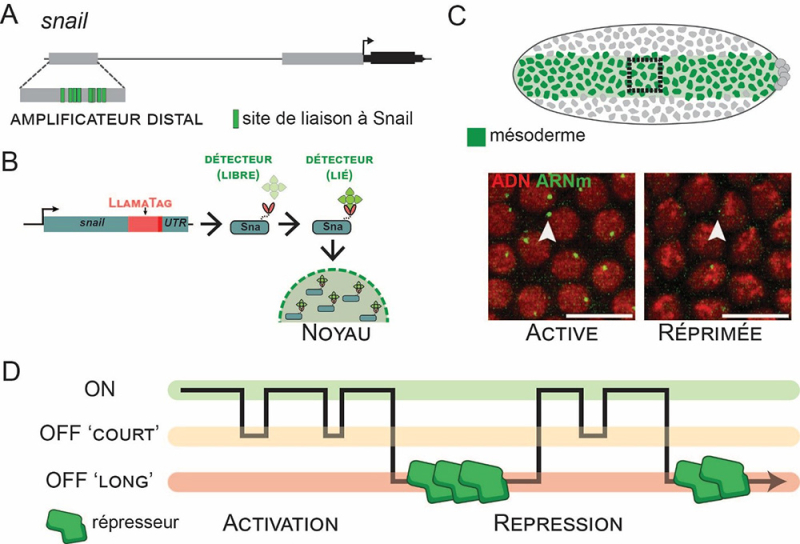
Figure : Les chefs d’orchestre du silence génétique : l’action coordonnée des facteurs de transcription, exemple de Snail.
A - Schéma du locus snail montrant les sites de liaison regroupés du facteur de transcription Snail (en vert) au niveau de l’enhancer distal.
B - Schéma du locus snail montrant l’ajout, par CRISPR, d’un LlamaTag à Snail, permettant la détection et la quantification en temps réel des niveaux de la protéine Snail dans des embryons vivants de Drosophila.
C - Un embryon de Drosophila (en haut) indiquant le mésoderme (en vert) où le gène snail est exprimé. La transcription de snail, suivie à l’aide de la technique MS2/MCP, comprend à la fois une phase active (en bas à gauche) avec une forte expression (pointe de flèche) et une phase réprimée (en bas à droite) avec une expression atténuée (pointe de flèche). Les ARNm sont marqués en vert (par la MCP-eGFP) et l’ADN en rouge (His2Av-RFP).
D - Schéma des dynamiques de transcription active (à gauche) et réprimée (à droite). L’état inactif « OFF long » nécessite l’action coopérative de multiples protéines répresseurs Snail (en vert) pour maintenir un silence transcriptionnel durant plusieurs minutes.
En savoir plus : Pimmett VL, Douaihy M, Maillard L, Trullo A, Garcia Idieder P, Costes M, Dufourt J, Lenden-Hasse H, Radulescu O, Lagha M. Coordinated active repression operates via transcription factor cooperativity and multiple inactive promoter states in a developing organism. Nat Commun. 2025 Sep 1;16(1):8157. doi: 10.1038/s41467-025-62907-3. PMID: 40890123; PMCID: PMC12402238.
Rouge: Noyaux (Histone-RFP)
Vert: Protéines Snail (Sna-LlamaTag)