Dans la structure des cryptochromes, le secret des horloges et boussoles biologiques
Les cryptochromes, protéines sensibles à la lumière bleue, règlent notre horloge biologique et pourraient aussi servir de boussole interne aux oiseaux migrateurs. Dans une étude parue dans la revue Science Advances, des scientifiques ont filmé, à l’échelle atomique et sur une échelle de temps allant de la nanoseconde à la centaine de millisecondes, la naissance du signal qu’ils génèrent. Ces découvertes permettent une meilleure compréhension du fonctionnement de l’horloge biologique et de la sensibilité magnétique.
Les photorécepteurs cryptochromes, horloges et boussoles biologiques
Les cryptochromes sont des photorécepteurs présents aussi bien chez les plantes que chez les animaux. Ils doivent leur nom à leur rôle resté longtemps énigmatique. On sait maintenant qu’ils sont impliqués dans les rythmes circadiens des plantes et des animaux et on les soupçonne fortement de servir également de boussole interne utilisée par certains oiseaux migrateurs. Chez l’humain, il en existe deux types, qui ajustent l’horloge circadienne sur le cycle jour-nuit. Ils forment une famille de flavoprotéines, des protéines capables de faire transiter des électrons grâce aux propriétés redox de leur cofacteur. Ils sont sensibles à la lumière bleue et, parfois, rouge. Ils sont apparentés aux photolyases (photoenzymes réparatrices de l’ADN) mais ont – pour la plupart – perdu cette fonction au cours de l’évolution.
Le cryptochrome de la petite algue verte Chlamydomonas reinhardtii (CraCRY), choisi par les scientifiques, est un modèle de choix pour étudier ces mécanismes. Bifonctionnel, il agit à la fois comme régulateur circadien et comme photolyase. Il constitue également un modèle idéal pour l’étude des mécanismes communs aux cryptochromes eucaryotes.
Observer un film moléculaire grâce à des techniques de pointe
Pour étudier CraCRY, les scientifiques, dans une étude publiée dans la revue Science Advances, ont combiné deux approches de très haute résolution, spatiale et/ou temporelle.
La cristallographie sérielle résolue en temps (TR-SFX) qui permet de voir des modifications de structure se produisant à l’échelle de la centaine de femtosecondes soit 10-10 secondes !
La spectroscopie in cristallo résolue en temps rendue possible grâce au nouvel instrument TR-icOS développé à Grenoble par l’IBS et l’ESRF.
Grâce à la TR-SFX, il a été possible d’enregistrer 19 instantanés à haute résolution de la structure du cryptochrome capturés entre quelques nanosecondes et quelques centaines de millisecondes après son activation par la lumière, sans dommages induits par les rayons X. Ce tour de force aura nécessité un grand consortium international de scientifiques, et la réalisation de plusieurs expériences au grand instrument du type laser à électrons libres (X-FEL) SACLA au Japon.
Les résultats montrent une suite d’événements structuraux, pour certains inattendus. Tout commence quand le cofacteur flavine absorbe un photon bleu, ce qui crée une paire radicalaire (cofacteur + protéine). Cette étape ouvre temporairement un chemin de transfert de protons entre la flavine et le solvant environnant permettant à la fois la modification structurale et spectroscopique de cette paire radicalaire par protonation. Le timing exact de l’étape de protonation n’a pu être validé qu’à l’aide de spectres enregistrés également en fonction du temps, directement sur des cristaux, grâce au nouvel instrument TR-icOS. Cette étape agit comme un commutateur permettant la formation de l’état de signalisation biologique, dans lequel une hélice alpha de la protéine est progressivement débobinée C’est ce qui explique le formidable découplage en temps entre la réaction photochimique ultrarapide et la formation du signal biologique : si la formation de l’état radicalaire se produisait en une seconde, le signal biologique ne serait accompli qu’après 7300 ans !
Une meilleure compréhension de la régulation de l’horloge circadienne et de la sensibilité magnétique
Ces découvertes éclairent le fonctionnement des cryptochromes en permettant de comprendre :
- Comment ils transmettent et amplifient un signal lumineux
- Comment ils changent de fonction (détection de la lumière bleue, de la lumière rouge, ou réparation de l’ADN).
Mais elles apportent aussi un nouvel éclairage sur leur rôle potentiel de capteurs magnétiques. En effet la paire radicalaire est sensible aux champs magnétiques faibles. L’étape de protonation décrite dans cette étude pourrait donc jouer un rôle clé dans la boussole interne des oiseaux migrateurs.
Enfin, les structures d’états intermédiaires et de signalisation de CraCRY offrent des pistes pour mieux comprendre comment certaines mutations des cryptochromes humains finissent par causer des troubles du sommeil.
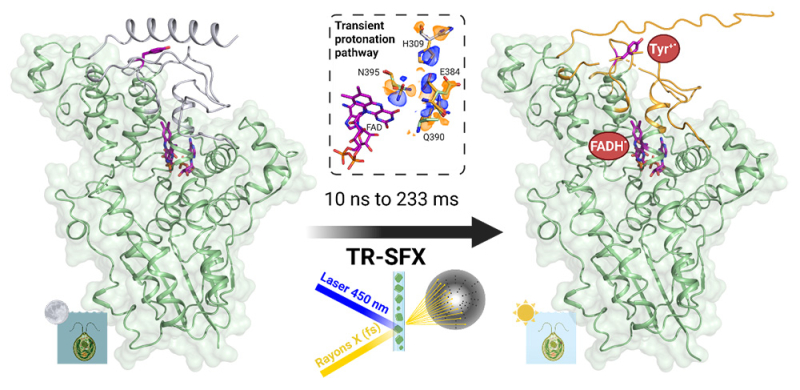
Figure : À gauche : la structure de l’état de base du cryptochrome CraCRY, dont le cofacteur flavine et la tyrosine exposée au solvant sont représentés en violet. Après illumination, une paire radicalaire se forme (flavine FADH• et tyrosine Tyr•+), puis s’ouvre un chemin de protonation transitoire (au centre, accompagné d’une carte de différence de densité électronique). À droite :Plusieurs centaines de millisecondes après illumination, l’hélice-alpha C-terminale de CraCRY se déplie, constituant l’état de signal physiologique de lumière.
En savoir plus : Maestre-Reyna M, Hosokawa Y, Wang PH, Saft M, Caramello N, Engilberge S, Franz-Badur S, Gusti Ngurah Putu EP, Nakamura M, Wu WJ, Wu HY, Lee CC, Huang WC, Huang KF, Chang YK, Yang CH, Fong MI, Lin WT, Yang KC, Ban Y, Imura T, Kazuoka A, Tanida E, Owada S, Joti Y, Tanaka R, Tanaka T, Kang J, Luo F, Tono K, Kiontke S, Korf L, Umena Y, Tosha T, Bessho Y, Nango E, Iwata S, Royant A, Tsai MD, Yamamoto J, Essen LO. Capturing structural intermediates in an animal-like cryptochrome photoreceptor by time-resolved crystallography. Sci Adv. 2025 May 16;11(20):eadu7247. doi: 10.1126/sciadv.adu7247. Epub 2025 May 16. PMID: 40378212; PMCID: PMC12083526.
Contact
Laboratoire
Institut de biologie structurale - IBS (CEA/CNRS/Université Grenoble Alpes)
71 Avenue des Martyrs
38000 Grenoble