Une régulation génétique inédite révélée au cœur du paludisme grave
Dans un article publié dans Cell Genomics, des scientifiques révèlent un nouvel élément régulateur de l’ADN, l’ESpromoter, doté d’une double fonction inédite : il agit à la fois comme accélérateur et frein sur deux gènes clés du système immunitaire. Une découverte majeure qui éclaire les mécanismes moléculaires à l’origine des formes graves du paludisme.
Dans notre corps, les gènes ne sont pas tous actifs en même temps. Leur activation est finement contrôlée pour assurer le bon fonctionnement de nos cellules. Ce contrôle est exercé par des régions spécifiques de l’ADN, appelées éléments régulateurs. Quand ces régions sont altérées, cela peut perturber l’activité des gènes et contribuer au développement de maladies comme les cancers, les troubles neurologiques ou encore le paludisme.
ESpromoter : un nouvel élément régulateur à double fonction dans les cellules immunitaires
Dans une étude menée sur les facteurs de susceptibilité aux formes graves du paludisme et publiée dans la revue Cell Genomics, les scientifiques ont découvert un nouveau type d’élément régulateur, baptisé ESpromoter.
Cette région régulatrice a une double fonction inédite dans les cellules immunitaires T, qui jouent un rôle central dans la défense contre les infections.
- Elle active l’expression du gène ATP2B4 (rôle d’enhancer),
- Et en même temps, elle freine l’expression du gène LAX1 (rôle de silencer),
dans une même cellule.
Ces deux gènes sont importants pour la régulation de deux fonctions biologiques essentielles que sont l’homéostasie du calcium et l’activation des cellules immunitaires T.
Quand les scientifiques suppriment cette région ESpromoter en modifiant le génome, le premier gène (ATP2B4) devient moins actif tandis que le second (LAX1) s’exprime davantage. Cela empêche l’activation des cellules T, ce qui peut altérer la réponse immunitaire.
Des variations génétiques discrètes aux effets puissants
Mais ce n’est pas tout, les scientifiques ont aussi repéré une petite variation génétique nommée rs11240391, située dans le promoteur du gène LAX1. Ce variant, qui passe souvent inaperçu dans les grandes études génétiques a pourtant un fort impact. En combinaison avec des variations de l’ESpromoter, il augmente le risque de développer une forme grave de paludisme et conduit à une diminution excessive de l’expression du gène LAX1, entraînant une hyperactivation des cellules T.
Grâce à une approche combinant des études génétiques, bio-informatiques et expérimentales, les scientifiques ont pu mieux identifier les éléments régulateurs cachés et leurs impacts sur les maladies complexes comme le paludisme. Ce travail ouvre la voie à une meilleure prise en compte des variations non-codantes de notre ADN, souvent négligées, mais qui peuvent jouer un rôle décisif dans notre santé.
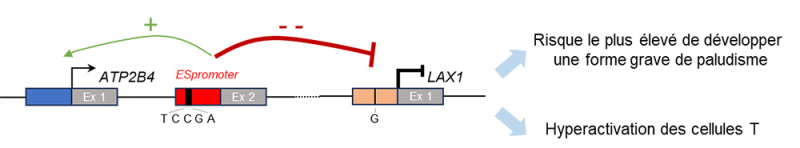
Figure : L'expression des gènes ATP2B4 et LAX1 est régulée par un nouveau type d’élément régulateur (ESpromoter), qui exerce simultanément des fonctions d’activation et de répression dans les cellules T. Cinq variations génétiques (rs11240734, rs1541252, rs1541253, rs1541254, et rs1541255) localisées dans l’ESpromoter, ainsi que la variation rs11240391 située dans le promoteur du gène LAX1 sont significativement associées au développement des formes graves de paludisme. Une interaction génétique entre ces variations a été mise en évidence indiquant que les individus porteurs de la combinaison TCCGA pour les variations de l’ESpromoter et de l’allèle G au niveau du promoteur de LAX1 présentent un risque particulièrement élevé de développer une forme sévère de la maladie. Cette combinaison agit de manière synergique, entraînant une répression accentuée de l’expression de LAX1 lorsque son promoteur contient l’allèle G. Ce mécanisme conduit à une hyperactivation des cellules T, contribuant à la sévérité du paludisme.
En savoir plus : Adjemout M, Nisar S, Escandell A, Torres R, Torres M, Nguyen Huu HT, Thiam A, Manosalva I, Mbengue B, Dieye A, Adoue V, Spicuglia S, Rihet P, Marquet S. Unraveling an enhancer-silencer regulatory element showing epistatic interaction with a variant that escaped genome-wide association studies. Cell Genom. 2025 May 23:100889. doi: 10.1016/j.xgen.2025.100889.
Contact
Laboratoire
Theories and Approaches of Genomic Complexity – TAGC (Aix Marseille Université/Inserm)
Parc Scientifique de Luminy case 928
163, Avenue de Luminy
13288 Marseille