Wolbachia manipule les spermatozoïdes d’insectes grâce à une toxine nucléaire
La bactérie Wolbachia vit dans les cellules de nombreuses espèces d’insectes. Son succès planétaire est lié à sa capacité à envahir les populations via un mécanisme de sélection mystérieux appelé incompatibilité cytoplasmique. Une étude utilisant les modèles drosophile et moustique vient de montrer que Wolbachia charge les noyaux des spermatozoïdes d’une protéine toxique capable de tuer les œufs dès la première division embryonnaire. Ces travaux sont publiés dans la revue Current Biology.
Vivre dans les cellules d’insectes… Une adaptation remarquable mais qui impose une contrainte de taille pour ces bactéries incapables de survivre en dehors de leur hôte. Seuls les œufs permettent à la bactérie Wolbachia de passer d’une génération à l’autre, tandis que les mâles et leurs spermatozoïdes compacts sont une impasse. La reproduction sexuée, majoritaire chez les arthropodes, représente donc une loterie très coûteuse pour la bactérie, au moins en apparence.
Depuis une cinquantaine d’années, on sait pourtant que les choses sont bien plus complexes. Wolbachia est en effet à l’origine de l’Incompatibilité Cytoplasmique (IC), un syndrome de stérilité énigmatique qui rebat singulièrement les cartes. Dans l’IC, les mâles infectés produisent des gamètes capables de tuer les œufs non-infectés mais épargnent ceux qui contiennent la bactérie. Résultat : une capacité redoutable d’envahissement des populations d’insectes. Cette propriété est d’ailleurs mise à profit par le World Mosquito Program (www.worldmosquitoprogram.org) pour propager la bactérie chez les moustiques du genre Aedes, vecteurs des dangereux arbovirus tels que la dengue (Wolbachia est en effet capable de bloquer la transmission des virus par les moustiques, mais c’est une autre histoire).
Si la découverte en 2017 par des chercheurs américains de deux protéines responsables de l’IC, CidA et CidB, a marqué une avancée décisive dans la compréhension du phénomène, leur rôle in vivo restait à élucider. Dans cette nouvelle étude, les scientifiques montrent que CidA et CidB, issues de la Wolbachia du moustique Culex pipiens, se comportent comme un couple toxine-antidote dans les cellules de drosophiles où elles ont été étudiées. La toxine CidB y est efficacement neutralisée par son association avec l’antidote CidA, mais induit la mort cellulaire lorsqu’elle est exprimée sans son partenaire. Chez les mâles transgéniques exprimant CidA et CidB, les deux protéines sont associées dans les cellules germinales jusqu’à la spermiogenèse, le processus de différenciation des spermatides en spermatozoïdes. Une analyse cytologique très fine a montré que CidA est éliminée des spermatides pendant la transition histone-protamine (stade final de la maturation des spermatozoïdes), tandis que la toxine CidB s’accumule dans les noyaux des gamètes. A la fécondation, en l’absence de Wolbachia dans les œufs, CidB reste associée au pronucleus mâle et perturbe gravement la réplication des chromosomes paternels selon un processus encore en cours d’investigation. La conséquence de ces dommages réplicatifs est la perte des chromosomes paternels dès la première division et la mort de l’embryon. En présence de Wolbachia dans les œufs, l’expression de l’antidote CidA permettrait de neutraliser CidB avant la première phase S, point qui reste encore à étudier.
La transmission de la toxine CidB par les spermatozoïdes est le premier cas documenté d’un effet trans-générationnel induit par une protéine bactérienne. Il ouvre par ailleurs des perspectives nouvelles sur la compréhension moléculaire de ce nouveau système toxine-antitoxine, lui-même au cœur des stratégies de lutte contre la transmission des arbovirus par les moustiques vecteurs.
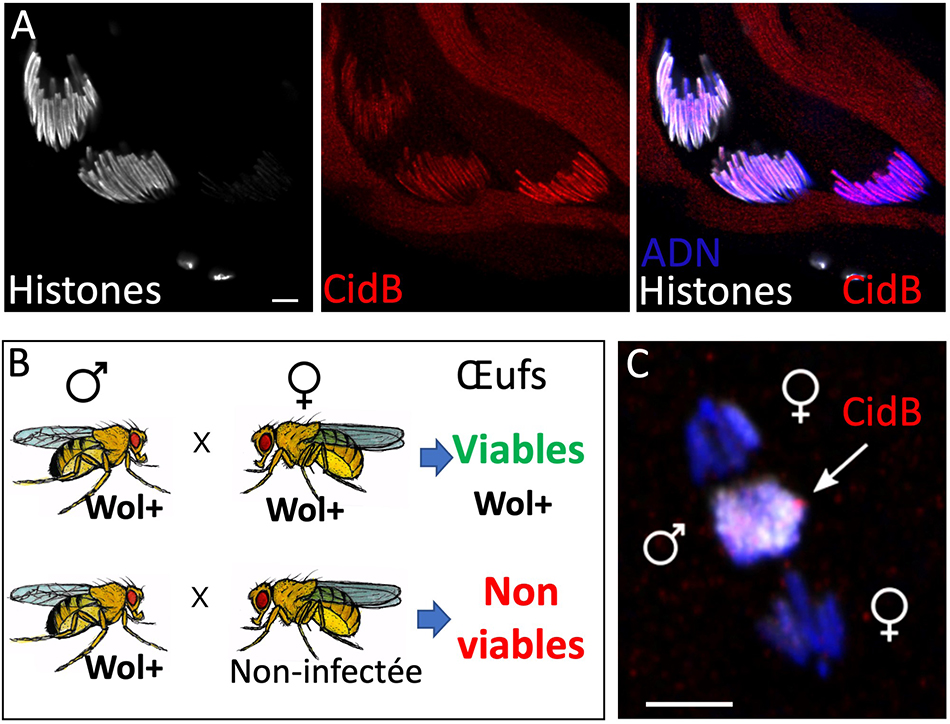
Figure :
A) Spermatides de drosophiles observées en microscopie confocale. La toxine de Wolbachia CidB (en rouge), est chargée dans les noyaux au moment où ceux-ci voient leurs histones éliminées lors de la transition histone-protamine.
B) l’Incompatibilité Cytoplasmique est un syndrome de stérilité observé lorsque des mâles infectées (Wol+) sont croisés avec des femelles non-infectées. Les embryons issus de ce croisement ne survivent pas. Lorsque les deux parents sont infectés, la survie des embryons est normale. Ce mécanisme contribue ainsi à sélectionner les œufs infectés.
C) Première division dans un embryon de drosophile « incompatible ». La toxine CidB (en rouge flèche), transmise par le spermatozoïde, est associée aux chromosomes paternels dont elle perturbe la réplication et la division. Les chromosomes maternels, eux, sont déjà séparés en anaphase. Barres d’échelle : 5 microns
Pour en savoir plus :
Paternal transmission of the Wolbachia CidB toxin underlies Cytoplasmic Incompatibility. Horard, B., Terretaz, K., Gosselin-Grenet, A., Sobry, H., Sicard, M., Landmann F., and Loppin, B. (2022).
Current Biology, 7 février 2022. DOI:https://doi.org/10.1016/j.cub.2022.01.052
Contact
Laboratoires
Laboratoire de biologie et de modélisation de la cellule (CNRS/Inserm/ENS de Lyon/Université Claude Bernard)
Site Monod
46 allee d'Italie
69364 Toulouse
Centre de recherche en biologie cellulaire de Montpellier (CNRS/Université de Montpellier)
1919 Route de Mende
34293 Montpellier