Vers une conception rationnelle de nouveaux adjuvants
La vaccination permet de prévenir et d’éliminer les maladies infectieuses, évitant, d’après l’Organisation Mondiale de la Santé, deux à trois millions de morts par an. Cependant afin d’augmenter son efficacité, il est nécessaire de développer des adjuvants qui accroissent la réponse immunitaire induite par les antigènes. Des chercheurs de l’Institut de pharmacologie et de biologie structurale, montrent qu’il est possible de concevoir une nouvelle génération d’adjuvants de façon rationnelle. Cette étude a été publiée le 21 février 2017 dans la revue PNAS.
Les vaccins sont principalement utilisés comme moyen de lutte contre les maladies infectieuses mais ils peuvent aussi être utilisés dans le cadre d’immunothérapies contre le cancer. Historiquement, les vaccins étaient composés d’agents pathogènes atténués, ou tués, mais ils peuvent générer des effets secondaires indésirables importants. Actuellement, la recherche se porte sur les vaccins sous-unitaires qui induisent une réponse mieux définie et plus sure contre des antigènes bien caractérisés et qui peuvent cibler soit des antigènes bactériens ou viraux soit des antigènes associés aux tumeurs.
Cependant, la réponse immunitaire contre ces antigènes est souvent faible et il est nécessaire de développer des adjuvants afin d’augmenter et d’orienter la réponse immunitaire induite par la vaccination. Les adjuvants majoritairement utilisés chez l’homme, tels que les adjuvants à base d’aluminium induisent une réponse lymphocytaire T de type Th2, qui cible efficacement les pathogènes extracellulaires mais est inefficace contre les pathogènes intracellulaires. Il est donc nécessaire de développer des adjuvants induisant une réponse cellulaire de type Th1 efficace contre des pathogènes intracellulaires comme le VIH, le virus de la grippe, Mycobacterium tuberculosis, mais également contre les cellules cancéreuses.
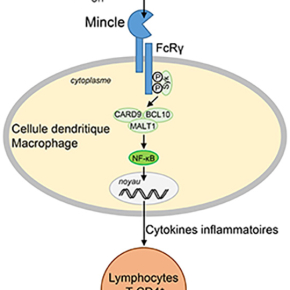
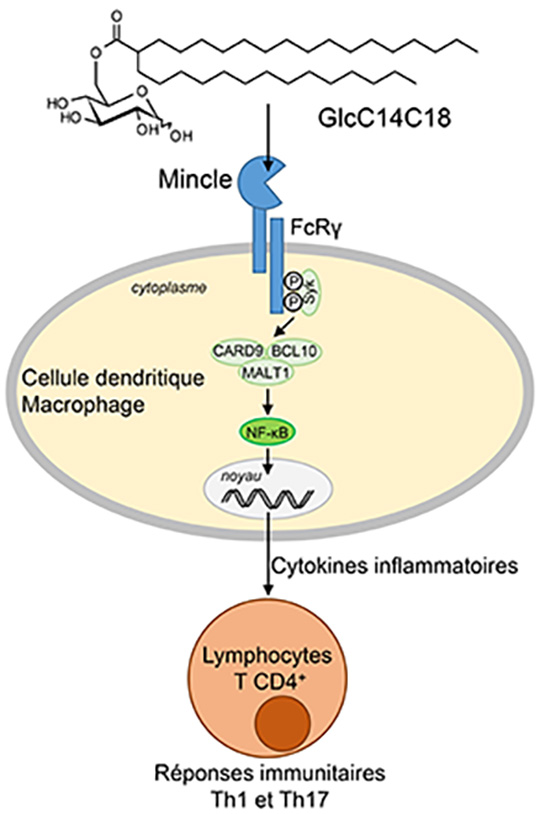
Pendant très longtemps, le développement d’adjuvants s’est fait de façon empirique. Récemment, la lectine de type C Mincle a été identifiée comme un récepteur conduisant au développement de réponses Th1, et Th17, via la reconnaissance de glycolipides microbiens, ouvrant ainsi la voie à la conception rationnelle de nouveaux adjuvants.
Au cours de cette étude, les chercheurs 1 ont utilisé une approche pluridisciplinaire combinant synthèse chimique, biologie cellulaire et bio-informatique afin de mieux décrypter les mécanismes moléculaires de reconnaissance des ligands de type glycolipidique par le récepteur. Ces données ont permis la conception rationnelle et la synthèse de nouveaux ligands spécifiques de Mincle, qui induisent une réponse immunitaire supérieure à celle des ligands actuellement disponibles, tout en étant beaucoup moins toxiques, et qui représentent donc de nouveaux candidats adjuvants.
© Jérôme Nigou
En savoir plus
-
Rational design of adjuvants targeting the C-type lectin Mincle.
Decout A, Silva-Gomes S, Drocourt D, Barbe S, André I, Cueto FJ, Lioux T, Sancho D, Pérouzel E, Vercellone A, Prandi J, Gilleron M, Tiraby G, Nigou J.
Proc Natl Acad Sci U S A. 2017 Feb 21. pii: 201612421. doi: 10.1073/pnas.1612421114.
- 1Ces travaux ont été réalisés en collaboration avec la société InvivoGen et le Laboratoire d'Ingénierie des Systèmes Biologiques et des Procédés