Une nouvelle famille de protéines liant le fer et le soufre découverte dans les virus géants
Certains virus géants de la famille des Mimiviridae possèdent de petites protéines exceptionnellement riches en glycine et en cystéine incorporant des agrégats de fer et de soufre (Fe-S) sous forme d’architectures de type [2Fe-2S] et [3Fe-4S] linéaire, cette dernière étant extrêmement rare dans le vivant. Ces protéines Fe-S sont très abondantes dans les particules virales et probablement essentielles pour l’infection. Ces travaux exploratoires, publiés dans la revue JACS, permettent d’aborder la question du rôle des centres Fe-S en virologie, un domaine quasiment inexploré à ce jour.
Les particules virales de mimivirus, le premier virus géant découvert en 2003, contiennent en abondance une petite protéine de 60 acides aminés composée principalement de glycine, de cystéine et de résidus aromatiques. La fonction de cette protéine est inconnue mais elle est très probablement essentielle lors de l’interaction hôte/virus.
La protéine virale produite dans la bactérie Escherichia coli présente une couleur rouge-brun témoignant de la présence de centres métalliques de type fer-soufre (Fe-S). En combinant des approches de spectroscopies RPE (Résonance paramagnétique électronique) et Mössbauer, les scientifiques ont montré que cette protéine, nommée GciS pour Glycine/Cysteine-rich Iron-sulfur, possède la capacité originale à lier des centres de type [2Fe-2S] et [3Fe-4S] linéaire, ce dernier étant un arrangement très inhabituel dans les protéines.
Les analyses bioinformatiques révèlent également que cette protéine est présente dans tous les clades des Megavirinae, une sous-famille des Mimiviridae, et les études biophysiques confirment que ses propriétés de liaison particulière de centres Fe-S sont une caractéristique commune à cette famille de protéines.
Ces travaux permettent de poser les premières bases pour l’exploration des propriétés structurales et fonctionnelles de ces protéines Fe-S virales inédites, avec à la clé de possibles découvertes de fonctions ou de métabolismes inconnus.
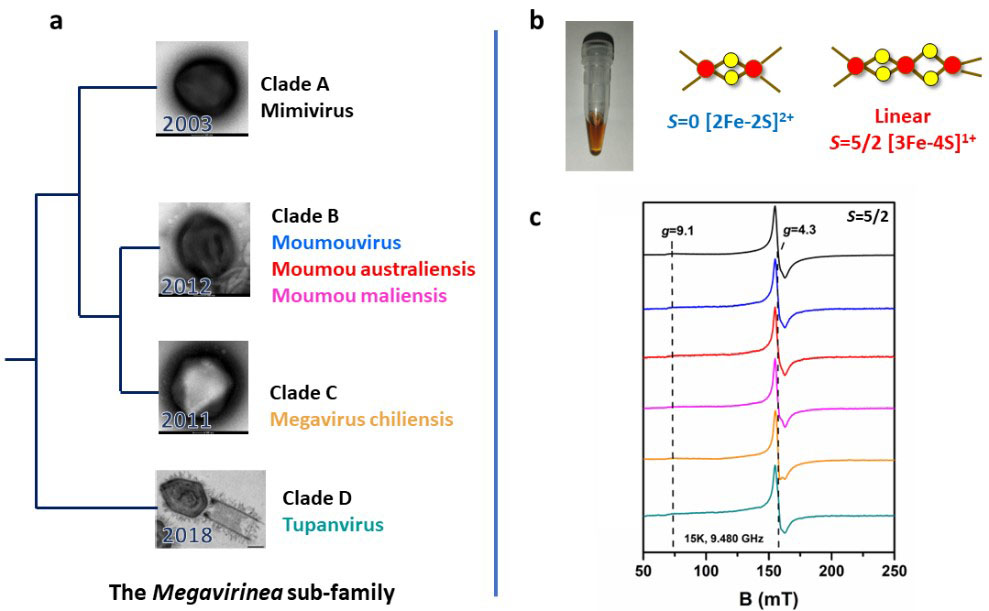
Figure : La famille des protéines GciS (Glycine/Cysteine-rich Iron-Sulfur).
La protéine GciS, présente au sein des différents clades des Megavirinae (a), une sous-famille des Mimiviridae, présente la capacité remarquable à lier des agrégats minéraux de fer et de soufre sous formes de [2Fe-2S]2+ et [3Fe-4S]1+ linéaire (b et c, signature RPE de centre [3Fe-4S]1+ linéaire de spin S=5/2 observée dans les membres des différents clades).
Pour en savoir plus :
Evidence for [2Fe-2S]2+ and linear [3Fe-4S]1+ clusters in a unique family of glycine/cysteine-rich Fe-S proteins from Megavirinae giant viruses.
Villalta, A. Srour, B. Lartigue, A. Clémancey, M. Byrne, D. Chaspoul, F. Loquet, A. Guigliarelli, B. Blondin, G. Abergel, C. Burlat, B.
J Am Chem Soc 2023 Jan 27. DOI:10.1021/jacs.2c10484.
Contact
Laboratoire
Laboratoire bioénergétique et ingénierie des protéines (CNRS / Université Aix-Marseille)
BIP - UMR 7281, Institut de microbiologie de la Méditerranée - IMM - FR 3479, IM2B
31 chemin Joseph Aiguier CS 70071
13402 Marseille cedex 09