Une mutation du régulateur majeur de virulence du Streptocoque du groupe A réduit la virulence
Les Streptocoques du Groupe A peuvent provoquer des infections de gravité très différentes, y compris chez des patients d’une même famille. Afin de déterminer les bases génétiques de ces différences chez le Streptocoque du Groupe A, des paires de souches provenant chacune d’une même famille mais présentant des caractères invasifs différents ont été analysés. Dans une des paires, une mutation unique a été découverte permettant de décrypter les mécanismes qui sont impliqués dans la virulence de Streptocoque du Groupe A. Ce travail est publié dans J. Bacteriol.
Streptococcus pyogenes, également connu sous le nom de streptocoque du groupe A (SGA), est responsable de 517 000 décès par an dans le monde, dont 163 000 sont dus à des infections invasives, et les autres aux séquelles post-infectieuses. Il y a actuellement une recrudescence d’infections bénignes et mortelles à SGA en Europe. Lors de cas groupés d’infections à SGA, des patients peuvent être atteints d’infections invasives graves et d’autres d’infections bénignes.
Les scientifiques se sont intéressés aux causes possibles de la bascule souche non-invasive – souche invasive. A cette fin, ils ont déterminé la séquence génomique de dix isolats provenant de cinq paires de souches, provenant de cinq foyers d’infection, et composées, chacune, d’une souche invasive et d’une souche de portage. Parmi ces paires, l’une présentait une différence d’un seul nucléotide dans le gène codant l’histidine kinase senseur, CovS, qui, avec CovR, forment le système de régulation à deux composants CovRS. CovRS contrôle l’expression de 15% du génome de SGA. CovR phosphorylé réprime la très grande majorité de ces gènes, dont de très nombreux gènes de virulence. CovS contrôle l’activité de CovR en le phosphorylant ou déphosphorylant selon les signaux environnementaux.
La présence du peptide antimicrobien LL-37 ou de Mg2+ favorise, respectivement, la phosphorylation et la déphosphorylation de CovR. Les souches de SGA invasives hébergent des protéines CovS non fonctionnelles conduisant à une absence de phosphorylation de CovR et une dé-répression de nombreux facteurs de virulence. Au contraire, dans cette étude, la souche mutée isolée est celle de portage. La mutation entraîne le remplacement de la tyrosine en position 39 par une histidine, CovS-Y39H. Ce résidu est le premier acide aminé après le domaine transmembranaire ; il est donc à une extrémité du domaine exposé à la surface, domaine qui reçoit les signaux de l’environnement LL-37 et Mg2+.
Les scientifiques ont analysé, par détermination des profils transcriptomiques des souches, les conséquences de cette mutation sur la régulation exercée par CovRS. La mutation CovS-Y39H affecte l’expression des gènes du régulon CovR d’une manière unique. Les gènes habituellement surexprimés dans les souches mutantes covS sont sous-exprimés et vice versa. Ces résultats suggèrent que la mutation CovS-Y39H augmente la proportion de CovR phosphorylé. En outre, l’expression des gènes de la souche comportant la mutation CovS-Y39H ne répond pratiquement plus à l’ajout des composés environnementaux, que ce soit LL-37 ou Mg2+. De par le mécanisme de phosphorylation – déphosphorylation de CovR par CovS, ces résultats suggèrent une forte diminution de l’activité phosphatase de la protéine mutée CovS-Y39H. Le dosage de l’accumulation de deux facteurs de virulence majeurs, la cystéine protéase SpeB et la streptolysine Slo, a montré qu’elle était modifiée de la même manière que la transcription de leurs gènes.
Les scientifiques se sont alors intéressés aux conséquences physiologiques de cette modification de régulation de l’expression des gènes de la souche mutante. Cette souche survit moins bien que son homologue de type sauvage dans les macrophages murins. Enfin, dans deux modèles murins d’infection, par inhalation et par injection intraveineuse, la souche mutante est moins virulente que l’isolat clinique sauvage provenant du même foyer.
Cette étude suggère que la mutation CovS-Y39H compromet l’activité phosphatase de CovS et que ceci conduit à une souche non-invasive. De plus, elle confirme l’importance de la dérépression de l’expression de la plupart des gènes de virulence, via des mutations ayant un impact sur la phosphorylation du régulateur CovR, pour favoriser les infections invasives à SGA.
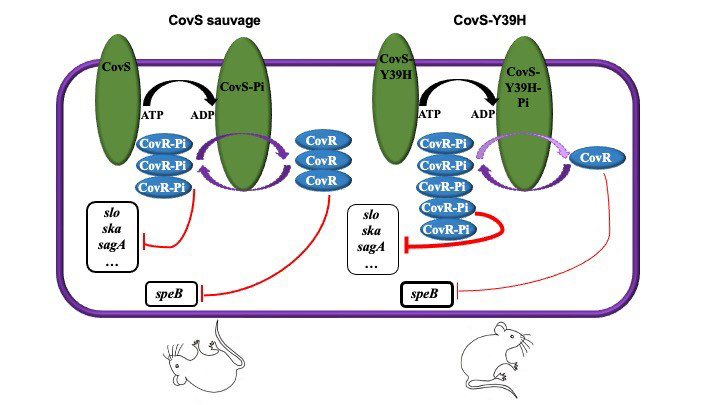
Figure :
L’isolat clinique produisant la protéine mutée CovS-Y39H produit beaucoup plus de CovR phosphorylé que la souche sauvage et de ce fait réprime l’expression de la majorité des gènes de virulence. Cet isolat, qui est une souche de portage, est moins virulente que la souche sauvage.
Pour en savoir plus :
A novel CovS variant harbored by a colonization strain reduces Streptococcus pyogenes virulence.
Plainvert C, Rosinski-Chupin I, Weckel A , Lambert C, Touak G, Elisabeth Sauvage E, Poyart C, Glaser P, Agnès Fouet A.
2023 J. Bacteriol. DOI : https://doi.org/10.1128/jb.00039-23
Contact
Laboratoire
Institut Cochin (Université Paris Cité/Inserm/CNRS)
22 rue Méchain
75014 Paris