Une condensation inattendue des ARNs dans le cerveau en vieillissement
Les condensats cytoplasmiques riches en ARN et protéines régulatrices participent à la compartimentalisation dynamique de l’expression génique. En combinant imagerie à haute résolution et approches fonctionnelles, les scientifiques ont découvert que les ARNs se condensent de façon sélective dans le cerveau en vieillissement et identifié les mécanismes sous-jacents. La condensation des ARNs étant associée à la répression de leur traduction, ces résultats, publiés dans la revue Nature Communications, ouvrent de nouvelles perspectives dans le domaine de la biologie du vieillissement.
Les condensats cytoplasmiques ribonucléoprotéiques (RNP), riches en ARNm et protéines régulatrices, sont présents dans divers types cellulaires et sont associés à des fonctions régulatrices ou de stockage. Au cours des dernières années, un lien clair a été établi entre l'accumulation d'agrégats RNP aberrants et la progression de maladies neurodégénératives liées au vieillissement. L'impact du vieillissement physiologique sur les condensats RNP neuronaux n'a cependant jamais été exploré en dehors des contextes pathologiques.
Par des techniques d'imagerie à haute résolution, les scientifiques ont découvert que les constituants des condensats RNP se condensent progressivement au cours du vieillissement pour former des granules de grande taille mais dynamiques dans le cerveau de drosophile. Par des approches fonctionnelles, ils montrent que cette condensation accrue est causée par une augmentation des niveaux de la protéine hélicase Me31B/DDX6 au cours du vieillissement, et qu’elle nécessite l’activité d’une kinase, PKA. Remarquablement, les espèces d'ARNm recrutées dans les condensats RNP au cours du vieillissement subissent une répression de leur traduction en protéines, indiquant que la condensation sélective d'ARNm et de répresseurs traductionnels pourrait contribuer aux changements d’expression génique observés au cours du vieillissement physiologique. De plus, les mécanismes mis en évidence pourraient être généralisables car l'hélicase Me31B/DDX6 et la kinase PKA sont évolutivement très conservée.
Ainsi, grâce à la combinaison d’approches cellulaires et fonctionnelles, cette étude a permis d’identifier un nouveau mécanisme impliqué dans la régulation sélective des transcrits dans le cerveau en vieillissement. En montrant l’impact de l’âge sur les propriétés des condensats RNP et la régulation spécifique des ARNm neuronaux, ce travail ouvre de nouvelles perspectives dans le domaine de la biologie du vieillissement.
Ces travaux sont extrêmement complémentaires à ceux co-publiés par une équipe de collaborateurs allemands dirigée par le professeur Michael Kiebler. Dans cette étude réalisée sur modèle murin, les chercheurs ont en effet mis en évidence des changements de propriétés des condensats riches en protéines DDX6 au cours de la maturation neuronale, renforçant l’idée qu’il s’agit d’un processus fondamental conservé au cours de l’évolution.
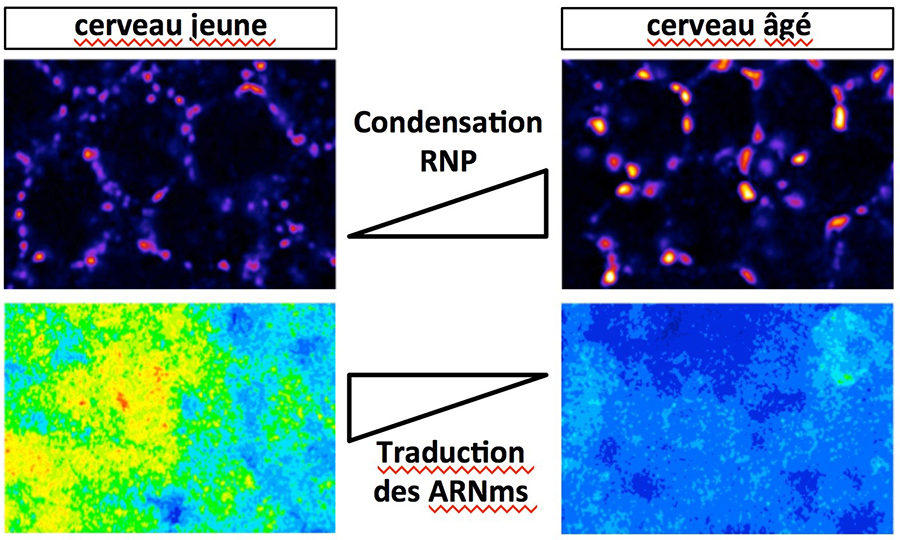
Figure : Au cours du vieillissement, ARNms et protéines associées se condensent pour former des granules cytoplasmiques de grande taille. Ce processus est lié à une répression de la traduction des ARNms. Les condensats RNP sont visualisés sur la ligne du haut et les niveaux d’expression de rapporteurs de traduction d’ARNms visualisés sur la ligne du bas.
Pour en savoir plus :
RNP components condense into repressive RNP granules in the aging brain
Pushpalatha KV, SolygaM, NakamuraA and Besse F
Nature communications 19 mai 2022, doi.org/10.1038/s41467-022-30066-4
Contact
Laboratoire
Institut de Biologie Valrose (iBV) (CNRS/Inserm/Université Côte d'Azur)
Parc Valrose, Nice