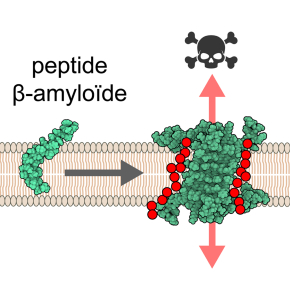
Un possible mécanisme de toxicité dans la maladie d’Alzheimer révélé par la structure d’oligomères du peptide β-amyloïde
Dans le cadre d’une collaboration internationale, des scientifiques ont déterminé pour la première fois la structure atomique d’oligomères du peptide β-amyloïde, impliqué dans la maladie d’Alzheimer. Ces oligomères, formés dans un environnement mimant la membrane cellulaire, provoquent une disruption de son intégrité laissant ainsi passer eau et ions. La connaissance de cette structure pourrait ainsi révéler un nouveau mécanisme de toxicité des oligomères du peptide β-amyloïde, une accumulation de ces derniers étant observée dans le cerveau aux stades précoces de la maladie d’Alzheimer. Ce travail est publié dans la revue Nature Communications.
La maladie d’Alzheimer est une maladie neurodégénérative qui est caractérisée par des pertes de mémoire et des fonctions cognitives chez les patients âgés. La protéine précurseur de l’amyloïde (APP) est impliquée dans le développement de la maladie, notamment par l’accumulation extracellulaire d’un petit peptide qui est le résultat de deux clivages successifs de l’AAP par les β- et γ-sécrétases. Ce peptide β-amyloïde (Aβ) est retrouvé dans des agrégats, dénommés plaques amyloïdes, dans le cerveau de patients Alzheimer. Aujourd’hui, la caractérisation de la forme exacte d’Aβ responsable de la neurotoxicité est toujours débattue. Un mécanisme encore peu décrit impliquerait la formation d’oligomères d’Aβ au sein de la membrane neuronale qui compromettrait l’intégrité de celle-ci.
Afin de comprendre ce possible mécanisme à l’échelle moléculaire, des chercheurs ont déterminé, pour la première fois, la structure atomique d’oligomères d’Aβ dans un environnement ressemblant à la membrane cellulaire. Par une combinaison de techniques avancées, telles que la Résonance Magnétique Nucléaire et la Spectrométrie de Masse Structurale (http://www.profiproteomics.fr), cette étude montre que l’élément constitutif des oligomères est formé par quatre copies du peptide Aβ (tétramères), assemblées sous forme de feuillets antiparallèles, ne présentant que peu de ressemblance structurale avec les fibres formant les plaques amyloïdes. Par ailleurs, cette étude révèle également l’existence d’oligomères plus grands (octamères) formant un « sandwich » de tétramères. Enfin, des simulations de dynamique moléculaire des oligomères ont mis en lumière un mécanisme de perméabilisation des membranes se traduisant par le passage d’eau et d’ions le long des oligomères.
Ainsi la formation de pores consécutive à l’insertion d’oligomères d’Aβ dans les membranes neuronales pourrait expliquer la neurotoxicité dans la maladie d’Alzheimer.
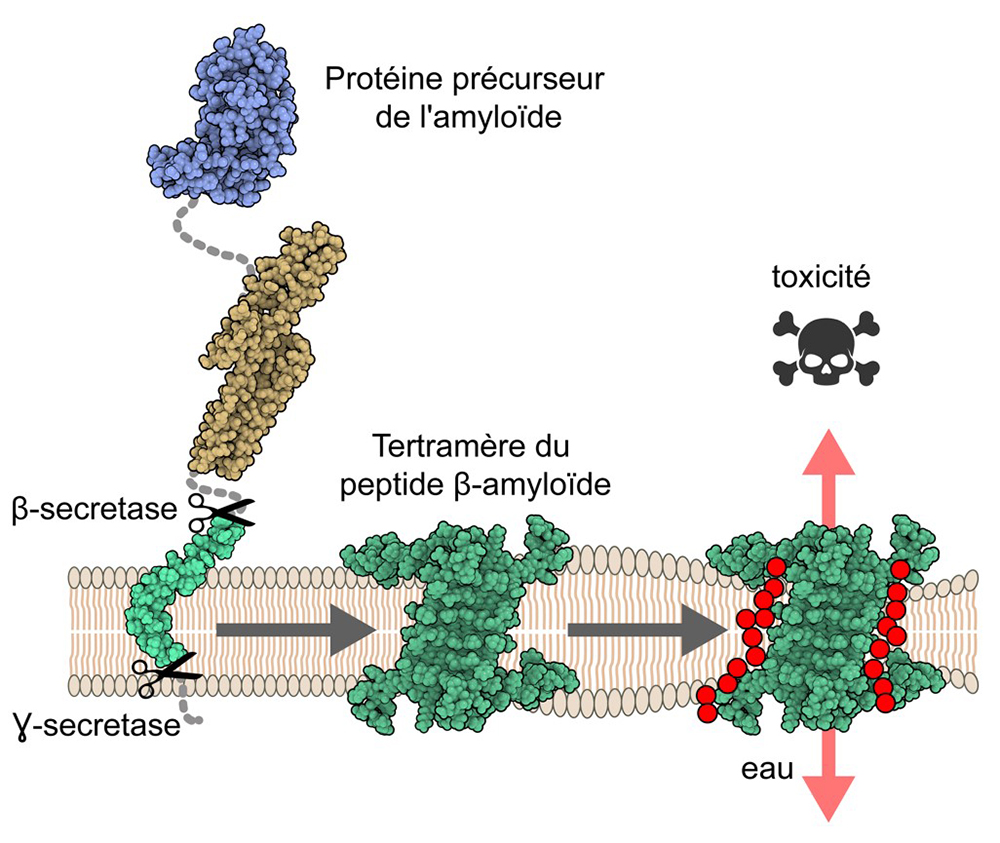
Figure : La protéine précurseur de l’amyloïde est insérée dans la membrane cellulaire des neurones. Après clivages successifs par les β- et γ-sécrétases, le peptide β-amyloïde (en vert) est libéré. Les oligomères membranaires sont formés par 4 ou 8 copies du peptide β-amyloïde. Les propriétés physico-chimiques des bords de ces oligomères forment un chemin pour le passage d’eau et d’ions (en rouge) au travers de la membrane, perturbant ainsi l’homéostasie ionique des cellules
Pour en savoir plus :
Aβ(1-42) tetramer and octamer structures reveal edge conductivity pores as a mechanism for membrane damage.
Ciudad S, Puig E, Botzanowski T, Meigooni M, Arango A, Do J, Mayzel M, Bayoumi M, Chaignepain S, Maglia G, Cianferani S, Orekhov V, Tajkhorshid E, Bardiaux B, Carulla N.
Nature Communications 15 Juin 2020 https://doi.org/10.1038/s41467-020-16566-1
Contact
Laboratoires
Biologie Structurale Intégrée des Processus Cellulaires et Agents Infectieux - (CNRS/ Institut Pasteur)
25-28 rue du Docteur Roux, 75724 Paris Cedex 15
Institut de Chimie et de Biologie des Membranes et des Nano-objets (CBMN) - Institut Européen de Chimie et Biologie (IECB) - (CNRS/ Université de Bordeaux/ Institut National Polytechnique Bordeaux Aquitaine)
2 rue Escarpit, 33600, Pessac, France
Institute for Research in Biomedicine (IRB Barcelona), The Barcelona Institute of Science and Technology (BIST)
Baldiri Reixac 10, 08028, Barcelona, Spain