Un point faible du bacille de la tuberculose identifié
Dans une étude parue dans PNAS, des scientifiques dévoilent que la survie de la bactérie responsable de la tuberculose, Mycobacterium tuberculosis, dépend d’un transporteur spécialisé lui permettant d’absorber le sulfate, une forme minérale de soufre. Ce transporteur est très spécifique de M. tuberculosis et pourrait donc être la cible de médicaments sans effet secondaire sur les cellules humaines.
La tuberculose, un ennemi toujours redoutable
La tuberculose reste aujourd’hui l’une des maladies infectieuses les plus redoutables. Chaque année, elle touche des millions de personnes à travers le monde et continue de faire de nombreuses victimes, malgré l’existence d’un vaccin et de traitements. En 2023, l’Organisation mondiale de la Santé recensait 10,8 millions de nouveaux cas. La situation se complique encore avec l’apparition de souches résistantes aux antibiotiques : ces bactéries échappent aux traitements actuels, déjà longs et difficiles à suivre, et rendent urgente la recherche de nouvelles solutions.
Comprendre le mode de vie de la bactérie pour mieux la combattre
La tuberculose est causée par une bactérie appelée Mycobacterium tuberculosis. Pour la combattre efficacement, il est indispensable d’élucider son mode de vie. Comment survit-elle dans notre organisme ? Comment détourne-t-elle nos défenses immunitaires à son avantage ? Et surtout, quels mécanismes lui permettent de persister pendant des années à l’état dormant, avant de se réactiver pour provoquer la maladie ?
C’est à ces questions fondamentales qu’une équipe de scientifiques français a choisi de s’attaquer, avec à la clé une avancée majeure publiée dans la revue PNAS.
Une découverte sur l’alimentation en soufre de la bactérie
Pendant longtemps, la communauté scientifique a pensé que la bactérie se nourrissait essentiellement de soufre organique, en particulier provenant de la méthionine, un acide aminé prélevé directement dans nos cellules. Mais cette étude bouleverse cette vision : les scientifiques montrent que M. tuberculosis préfère en réalité importer du sulfate « inorganique », une forme de soufre présente dans notre organisme, grâce à un transporteur spécialisé baptisé SubI-CysTWA.
Pour parvenir à ce résultat, ils ont utilisé une technologie d’imagerie très précise, appelée NanoSIMS, qui permet de voir les éléments chimiques, et donc le soufre, directement dans les cellules infectées par la bactérie. Ils ont ainsi observé que la bactérie stocke d’importantes quantités de soufre issu du sulfate, en particulier lorsqu’elle est en pleine activité.
Un point faible à exploiter pour de futurs traitements
Les scientifiques ont ensuite inactivé le gène responsable de l’expression de ce transporteur. Résultat : la croissance de la bactérie cultivée en laboratoire était ralentie et sa survie a diminué dans les poumons de souris infectées. Elle est aussi devenue plus sensible au stress oxydatif, une réaction naturelle de nos défenses pour lutter contre les agents pathogènes.
Cette dépendance est particulièrement intéressante car le transporteur SubI-CysTWA n’existe que chez M. tuberculosis. Des médicaments ciblant ce mécanisme pourraient donc affaiblir la bactérie sans nuire aux cellules humaines. Une telle approche pourrait renforcer l’efficacité d’antibiotiques déjà utilisés, comme l’isoniazide, et aider à raccourcir les traitements.
Une avancée prometteuse
Dans un contexte où les traitements actuels sont longs et où les résistances se multiplient, cette découverte ouvre une nouvelle piste : bloquer l’accès au sulfate pour empêcher la bactérie de se défendre. À terme, cela pourrait améliorer l’efficacité des soins, limiter les résistances et ainsi sauver de nombreuses vies.
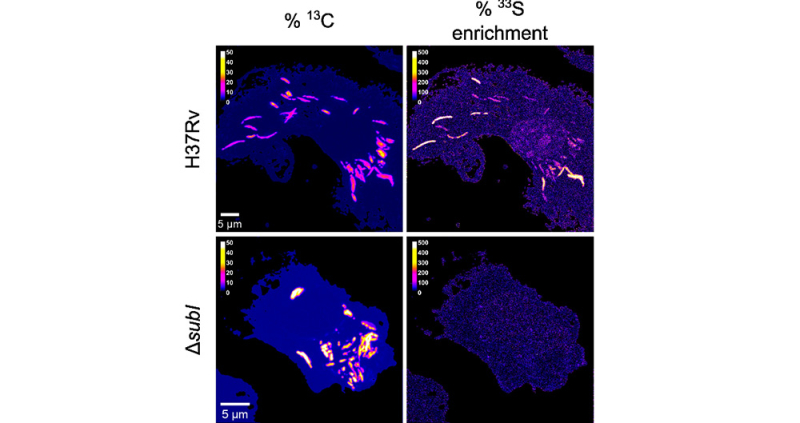
Figure : Le transporteur SubI est nécessaire pour l’import de sulfate dans les bactéries intracellulaires. Les bactéries (M. tuberculosis) ont été cultivées en présence de glucose marqué avec l’isotope 13C pour pouvoir les visualiser dans les macrophages infectés (panels de gauche). Les cellules ont été incubées avec du sulfate marqué au 33S pour pouvoir suivre la molécule dans les cellules infectées (panels de droite). Les c ellules ont été infectées avec des bactéries sauvages (panels du haut) ou un mutant inactivé dans le transporteur SubI (panels du bas). La figure montre l’accumulation de sulfate dans les bactéries sauvages, mais pas dans les bactéries n’exprimant pas le transporteur.
En savoir plus : W. Le Mouëllic, F. Levillain, T. Wu, M. Caouaille, P. Bousso, Y. Poquet, & O. Neyrolles. Inorganic sulfate is critical for Mycobacterium tuberculosis lung tissue colonization and redox balance, Proc. Natl. Acad. Sci. U.S.A. 122 (39) e2503966122. https://doi.org/10.1073/pnas.2503966122 (2025).
Contact
Laboratoire
Institut de pharmacologie et biologie structurale - IPBS (CNRS/Université de Toulouse)
205 route de Narbonne
31400 Toulouse
France