Un nouvel outil dans la lutte contre des cancers de l’estomac liés à la bactérie Helicobacter pylori
Les souches les plus virulentes de la bactérie Helicobacter pylori peuvent provoquer des ulcères et cancers de l’estomac. Ces organismes produisent une seringue moléculaire qui injecte une oncoprotéine, CagA, dans les cellules gastriques. Dans cet article publié dans la revue Plos Pathogens, les scientifiques ont révélé les détails structuraux d’un nouveau composant de cette seringue et identifié des inhibiteurs réduisant l’efficacité de celle-ci d’environ 65 %, ouvrant ainsi la voie à de nouvelles cibles pour inhiber complétement l’entrée de CagA.
Helicobacter pylori est une bactérie unique dans son genre qui vit dans l’estomac humain. Très efficace, on estime qu’elle colonise la moitié de la population mondiale. Si la majorité des individus infectés se porte bien, 20 % développeront un ulcère et 1 à 3 % un cancer de l’estomac. Nous savons depuis une vingtaine d’année que les souches les plus virulentes (les plus fréquemment associées aux cancers) produisent un système de sécrétion de type IV (T4SS) : une machinerie moléculaire agissant comme une seringue qui permet à la bactérie d’injecter la protéine CagA dans les cellules de l’estomac. CagA a toutes les caractéristiques d’une oncoprotéine et, une fois injectée, elle provoque des transformations cellulaires qui peuvent conduire au développement de tumeurs. Pour ces raisons, Helicobacter pylori est considérée comme un carcinogène de classe 1 par l’Agence internationale de recherche contre le cancer (IARC) de l’Organisation mondiale de la santé (OMS), au même titre que la cigarette.
Dans cet article, les scientifiques ont tout d’abord découvert que CagI, une protéine du T4SS de la bactérie jusqu’ici relativement peu étudiée, était capable de s’attacher sur les cellules humaines et d’induire des changements morphologiques de ces dernières. Des approches de modélisation et de biochimie ont permis d’identifier le domaine de CagI impliqué et montrer que ce domaine seul était suffisant pour un attachement maximal sur les cellules gastriques.
Les scientifiques sont ensuite parvenus à produire puis caractériser de petites protéines synthétiques appelés DARPins (Design Ankyrin Repeat Proteins) dirigés contre CagI, qui se comportent comme des mini anticorps. Une fois produites et isolées, ces molécules ont une affinité très forte pour leur cible et en particulier pour le domaine C-terminal de CagI. De manière intéressante, le plus affin de ces DARPins est capable de réduire l’attachement des cellules humaines sur CagI de près de 80 %. Puis, les scientifiques ont déterminé la structure d’un complexe DARPin-CagI, et mis en évidence les épitopes potentiellement impliqués dans l’attachement de CagI aux cellules. Afin de déterminer si les DARPins pouvaient avoir un effet in vivo, ils ont mis au point un essai d’inhibition. En plaçant les bactéries Helicobacter pylori sur les cellules humaines en absence ou en présence du DARPin, ils ont découvert que ce dernier réduisait de près de 65 % l’injection de CagA.
Ainsi, ces résultats permettent une meilleure compréhension des mécanismes moléculaires de l’injection de CagA. Ils suggèrent notamment que CagI joue un rôle essentiel dans le fonctionnement de cette seringue, vraisemblablement en permettant à l’aiguille de la seringue d’interagir avec les cellules gastriques. De plus, ces résultats montrent pour la première fois que l’on peut réduire la capacité d'Helicobacter pylori à injecter l’oncoprotéine, ce qui ouvre la voie à de nouvelles stratégies de lutte contre ces infections qui sont à l’origine de l’apparition des cancers gastriques.
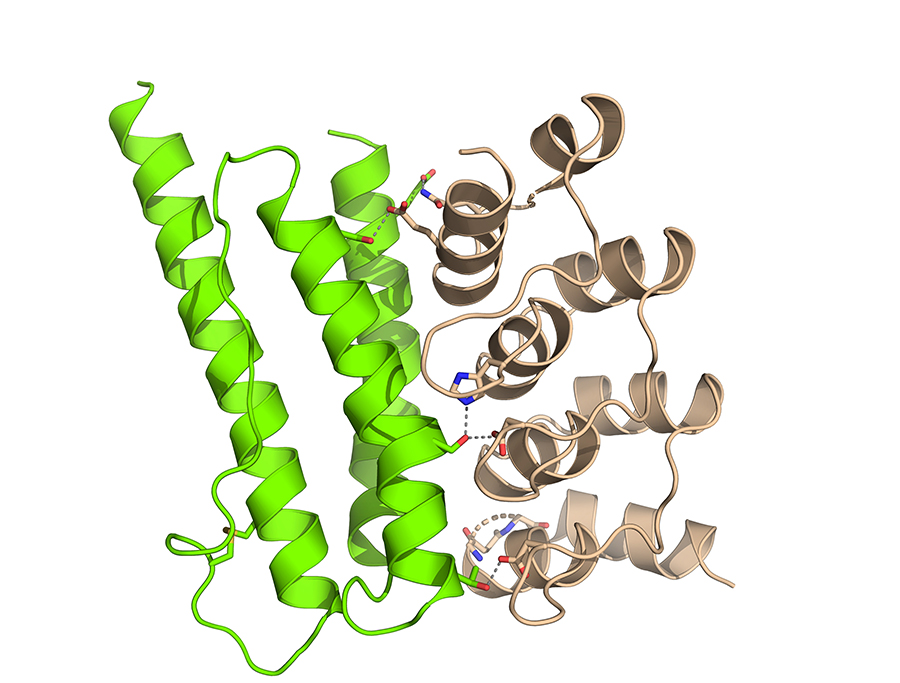
Figure : Structure cristallographique du complexe entre CagI (en vert) et le DARPin en beige.
Pour en savoir plus :
Designed Ankyrin Repeat Proteins provide insights into the structure and function of CagI and are potent inhibitors of CagA translocation by the Helicobacter pylori type IV secretion system
Marine Blanc, Clara Lettl, Jérémy Guérin, Anaïs Vieille, Sven Furler, Sylvie Briand-Schumacher, Birgit Dreier, Célia Bergé, Andreas Plückthun, Sandrine Vadon-Le Goff, Rémi Fronzes, Patricia Rousselle, Wolfgang Fischer, Laurent Terradot.
Plos Pathogens, May 8, 2023. DOI:https://doi.org/10.1371/journal.ppat.1011368
Contact
Laboratoire
Laboratoire de microbiologie moléculaire et biochimie structurale (CNRS / Université Lyon 1)
Institut de biologie et chimie des protéines - IBCP
7, passage du Vercors
9007 Lyon