Un nouvel ARN chaperon et une ARN hélicase accompagnent la naissance de la grande sous-unité du ribosome
Dans les cellules eucaryotes, les événements moléculaires qui sous-tendent l'assemblage et la maturation des premières particules précurseurs de la grande sous-unité du ribosome restent mal compris. Dans deux articles publiés dans la revue Nature Communications, les scientifiques ont caractérisé la fonction de deux acteurs importants de ce processus : le petit ARN nucléolaire (snoARN) snR190 et l'ARN hélicase Dbp7. snR190 agit comme un ARN chaperon dans la structuration de l'ARN ribosomique, tandis que l’ARN hélicase Dbp7 est importante pour dissocier snR190 de l’ARNr une fois sa fonction accomplie, pour permettre la formation du centre catalytique de la grande sous-unité ribosomique.
Les ribosomes sont les machines cellulaires universelles responsables de la synthèse des protéines. Ils sont composés de deux sous-unités (40S et 60S), chacune constituée d’un assemblage de molécules d’ARN (ARN ribosomiques, ARNr) repliées en une structure tridimensionnelle précise, et de protéines ribosomiques. Dans les cellules eucaryotes, la synthèse des ribosomes débute dans une région du noyau appelée le nucléole. Les premières étapes consistent en l’assemblage de particules précurseurs contenant les précurseurs des ARNr, des protéines ribosomiques et de nombreux facteurs accessoires appelés facteurs d’assemblage et de maturation. Pour devenir des ribosomes fonctionnels, ces particules sont l’objet d’un processus de maturation complexe au cours duquel les ARNr précurseurs subissent des coupures précises, des modifications chimiques de nucléotides et une succession de repliements qui génèrent leur structure tridimensionnelle finale. Ces événements font intervenir deux familles de petites molécules d’ARN nucléolaires appelées snoARN. Celles-ci s’apparient de manière très précise avec certaines régions des ARNr en cours de maturation, soit pour y introduire des modifications chimiques (ce sont alors des snoARN guides de modifications), soit pour faciliter leur repliement (on parle alors de snoARN chaperons). Les appariements entre les snoARN et les ARNr sont régulés par une famille de protéines particulières, les hélicases à ARN, qui ont la capacité, entre d’autres activités, de séparer deux molécules d’ARN appariées (activité hélicase).
Si la grande majorité des facteurs impliqués dans l’assemblage et la maturation des particules précurseurs des ribosomes sont connus à l’heure actuelle, leurs rôles moléculaires précis restent à définir. Les chercheurs, en collaboration avec l’Université de Séville en Espagne et l’Université de Göttingen en Allemagne, ont récemment élucidé le rôle moléculaire de deux facteurs impliqués dans la formation de la grande sous-unité du ribosomes (60S) chez la levure : le petit ARN nucléolaire snR190 et l’ARN hélicase Dbp7. Par une combinaison d’approches génétiques et biochimiques ils ont mis en évidence que le snoARN snR190 est un nouvel ARN chaperon qui s’apparie avec deux régions de l’ARNr pour permettre leur repliement correct. Une fois sa fonction accomplie, l’appariement entre snR190 et l’ARNr est dissocié par l’ARN hélicase Dbp7 afin de permettre les événements de maturation ultérieurs. Ces événements moléculaires sont nécessaires à la structuration du centre catalytique de la grande sous-unité du ribosome où sont synthétisées les protéines naissantes.
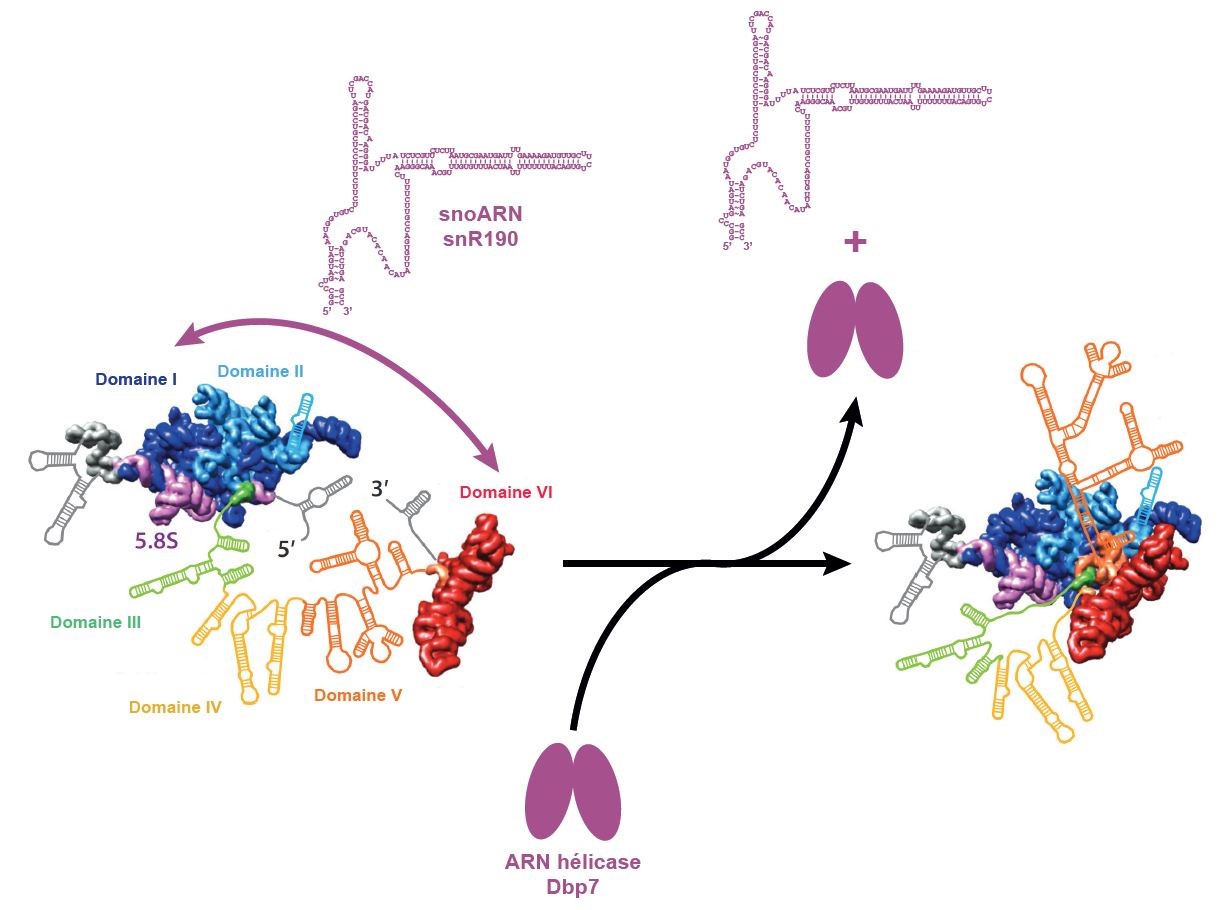
Figure : L’ARN de la grande sous-unité du ribosome est organisé en six domaines structuraux (I à VI) représentés de différentes couleurs. Le snoARN snR190 s’apparie au domaines I et VI pour faciliter leur repliement. Une fois la fonction moléculaire de snR190 accomplie, celui-ci est dissocié de l’ARN ribosomique par l’ARN hélicase Dbp7, ce qui permet la structuration du centre catalytique de la grande sous-unité ribosomique.
Pour en savoir plus:
Association of snR190 snoRNA chaperone with early pre-60S particles is regulated by the RNA helicase Dbp7 in yeast.
Jaafar M, Contreras J, Dominique C, Martín-Villanueva S, Capeyrou R, Vitali P, Rodríguez-Galán O, Velasco C, Humbert O, Watkins NJ, Villalobo E, Bohnsack KE, Bohnsack MT, Henry Y, Merhi RA, de la Cruz J, Henras AK.
Nature Communication 2021 Oct 22. doi: 10.1038/s41467-021-26207-w.
The RNA helicase Dbp7 promotes domain V/VI compaction and stabilization of inter-domain interactions during early 60S assembly.
Aquino GRR, Hackert P, Krogh N, Pan KT, Jaafar M, Henras AK, Nielsen H, Urlaub H, Bohnsack KE, Bohnsack MT.Nature Communication 2021 Oct 22. doi: 10.1038/s41467-021-26208-9.
Contact
Laboratoire
Unité de biologie moléculaire, cellulaire et du développement (MCD)
Centre de biologie intégrative (CBI) (CNRS/Université de Toulouse)
169 avenue Marianne Grunberg-Manago
31062 Toulouse Cedex 09, France