Un nouvel acteur de la synthèse des ribosomes chez l’homme impliqué dans la dyskératose congénitale
La synthèse des protéines est une activité vitale assurée, dans chaque cellule humaine, par 5 à 10 millions de ribosomes. Ces usines moléculaires, elles-mêmes formées d'ARN et de protéines, sont assemblées suivant une séquence complexe et très énergivore dont la défaillance est la cause de différentes pathologies. L'équipe de Pierre-Emmanuel Gleizes au Laboratoire de biologie moléculaire eucaryote, en collaboration avec l'équipe d'Ulrike Kutay à l'Ecole Polytechnique Fédérale de Zürich, révèle que la protéine PARN, une enzyme mutée dans plusieurs maladies rares, dont la dyskératose congénitale, est un acteur inattendu de l'assemblage des ribosomes. Cette étude est parue le 10 avril 2017 dans la revue Nucleic Acids Research.
Les ARN agissent dans l'ensemble du monde vivant comme médiateurs de l'information génétique, régulateurs de l'expression génique ou composants de machineries moléculaires. Ils se présentent sous forme de chaînes composées d’un alphabet de quatre lettres ou nucléotides. Les ARN les plus abondants sont ceux qui constituent les ribosomes, les machines moléculaires qui synthétisent les protéines. Chez les mammifères, quatre ARN ribosomiques s'associent avec 80 protéines pour former les deux sous-unités constituant le ribosome, appelées 40S et 60S. Plusieurs maladies génétiques, mais aussi des cancers, sont liés à des défauts de formation des ARN ribosomiques, un processus complexe dont il reste à caractériser les nombreux acteurs chez l'homme.
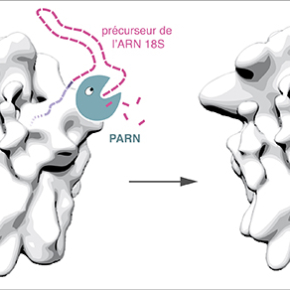
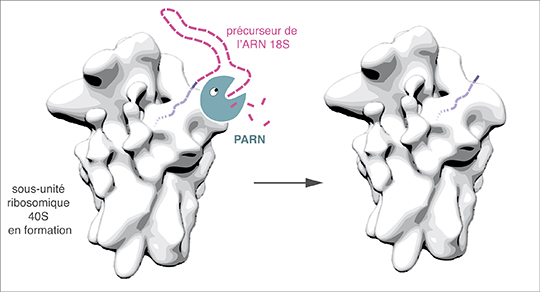
Les ARN ribosomiques émanent de longs ARN précurseurs (ARN pré-ribosomiques) qui sont clivés par des enzymes appelées ribonucléases agissant comme des ciseaux ou des grignoteuses. Plusieurs des ribonucléases qui cisèlent les ARN ribosomiques restent à identifier chez l’homme. La protéine PARN (Poly-Adenosine specific RiboNuclease) est une ribonucléase bien connue pour sa capacité à "grignoter" certains ARN à partir d'une de leurs extrémités (on parle d'exoribonucléase). Elle a la particularité de montrer une forte préférence pour les segments d'ARN formés d'une répétition d'adénosines, un des quatre nucléotides. Or la faible abondance d'adénosines dans les ARN pré-ribosomiques faisait de PARN un candidat improbable pour jouer un rôle dans la formation des ribosomes.
Pourtant, les chercheurs ont découvert que PARN était aussi présente dans des précurseurs de la sous-unité ribosomique 40S à des stades précoces de sa formation. Ils ont utilisé plusieurs approches pour abroger la fonction de PARN dans des cellules et ont pu ainsi observer que cette enzyme était nécessaire à la maturation correcte de l'ARN 18S, qui structure la sous-unité ribosomique 40S. Testée directement in vitrosur un ARN reproduisant l'extrémité du précurseur de l'ARN 18S, la protéine PARN purifiée s'est révélée capable de digérer ce substrat. En accord avec ces résultats, on retrouve PARN en grande quantité dans le nucléole, le domaine du noyau où sont produits les ribosomes.
Ces données font de PARN un nouvel acteur de la formation des ribosomes, une fonction inattendue pour cette enzyme. D'autres rôles ont aussi été proposés récemment pour cette enzyme dans la maturation de petits ARN non-codants, dont l'ARN de la télomérase qui assure le maintien de l'extrémité des chromosomes (télomères). Parallèlement, des mutations dans PARN ont été associées à la dyskératose congénitale ou à la fibrose pulmonaire idiopathique, des maladies génétiques caractérisées par la perte progressive des télomères. Comme PARN, deux autres protéines mutées dans la dyskératose congénitale, DKC1 et NHP2, sont requises à la fois pour la synthèse des ribosomes et la formation de la télomérase. Cette nouvelle fonction de PARN dans la production des ribosomes renforce donc l'idée encore débattue qu'un défaut de synthèse des ribosomes participe à l'étiologie de cette pathologie, en particulier dans les cas les plus sévères.
© Pierre-Emmanuel Gleizes.
En savoir plus
-
Poly(A)-specific ribonuclease is a nuclear ribosome biogenesis factor involved in human 18S rRNA maturation.
Montellese C, Montel-Lehry N, Henras AK, Kutay U, Gleizes PE, O'Donohue MF.
Nucleic Acids Res. 2017 Apr 10. doi: 10.1093/nar/gkx253