Un mécanisme de surcharge systémique en fer dans un syndrome myélodysplasique
Les syndromes myélodysplasiques sont des maladies clonales de la cellule souche hématopoïétique. Les syndromes myélodysplasiques avec sidéroblastes en couronne (SMD-SC) en sont un sous-type particulier associé dans plus de 90% des cas à la présence d’une mutation du gène codant le facteur d’épissage SF3B1. Elles sont caractérisées par une accumulation systémique du fer avant toute transfusion de globules rouges. Les chercheurs ont découvert un mécanisme de surcharge systémique en fer chez les patients porteurs d’un syndrome myélodysplasique avec mutation du gène SF3B1. Cette étude est publiée dans la revue Science Translational Medicine.
La découverte, ces dernières années, des mutations somatiques de gènes d’épissage de l’ARN dans les cancers a conduit à une recherche intensive des anomalies des transcrits par séquençage global de l’ARN, dans le but d’identifier le ou les mécanismes de la cancérogenèse. L’objectif est d'optimiser l’utilisation des agents pharmacologiques ciblant l’épissage tels que les molécules interférant avec la capacité du complexe SF3b d’interagir avec l’ARN. Ces molécules, dont certaines sont en essai clinique de phase 1, ne sont pas dénuées de toxicité ce qui suggère de les proposer seulement aux patients dont le pronostic est défavorable.
Les mutations du gène d’épissage SF3B1 sont restreintes à certains cancers, dont les syndromes myélodysplasiques avec sidéroblastes en couronne. Les patients porteurs de ce syndrome se présentent avec des anémies profondes, des besoins transfusionnels élevés et une résistance aux agents stimulant l’érythropoïèse. Leur médiane de survie est de 9 ans avec un risque de transformation en leucémie aiguë de 15%.
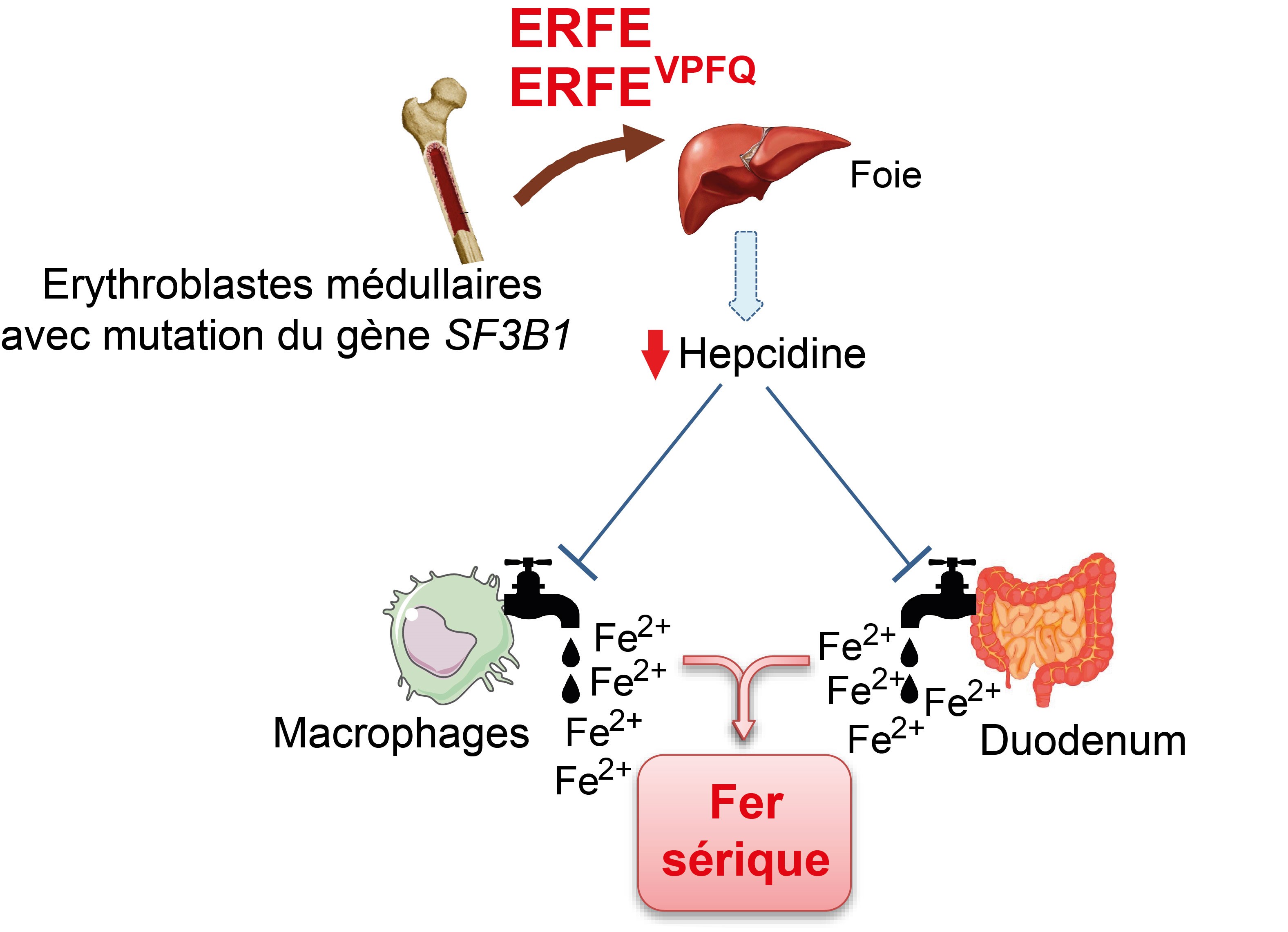
A partir des données de « RNA-sequencing » des cellules de moelle osseuse des patients porteurs d’un syndrome myélodysplasique avec mutation du gène SF3B1, les chercheurs ont identifié un transcrit variant du gène codant l’érythroferrone (ERFE, un régulateur érythroïde du fer) parmi ceux dont l’expression globale est augmentée. Ce transcrit aberrant est détecté dans les érythroblastes uniquement si le gène SF3B1 est muté, ce qui en fait un biomarqueur de l’érythropoïèse clonale. Il est traduit en une protéine variante (ERFEVPFQ) présentant 4 acides aminés supplémentaires et qui coexiste avec la version "sauvage" de la protéine.
L’hepcidine est le principal régulateur de l’homéostasie du fer chez les mammifères, permettant l’adaptation des taux de fer circulant selon les besoins en régulant l’import de fer dans le duodénum et le recyclage du fer par les macrophages. L’érythroferrone produite par les cellules érythroïdes de la moelle osseuse a été décrite comme étant un répresseur transcriptionnel majeur de l’hepcidine. Dans ce travail, les chercheurs montrent que la protéine variante réprime, comme la protéine sauvage, la transcription de l’hepcidine dans les cellules de lignées d’hépatocarcinome. Ils observent également que l’érythroferrone dosée par test ELISA dans le plasma de patients est anormalement élevée et ce taux élevé d’érythroferrone est prédictif de la surcharge en fer.
En résumé, cette étude a identifié pour la première fois un variant protéique induit par la présence d’une mutation du gène d’épissage SF3B1 dans les érythroblastes de patients. Ce variant contribue à l’élévation des taux plasmatiques d’érythroferrone. II en résulte une répression accrue de l’hepcidine et une augmentation du fer sérique en comparaison avec les syndromes myélodysplasiques sans mutation du gène SF3B1. Chez les patients porteurs d’un syndrome myélodysplasique avec mutation du gène SF3B1, le variant d’épissage de l’érythroferrone pourrait constituer une cible thérapeutique.
© Carine Lefèvre
Pour en savoir plus :
A variant erythroferrone disrupts iron homeostasis in SF3B1-mutated myelodysplastic syndrome.
Bondu S, Alary AS, Lefèvre C, Houy A, Jung G, Lefebvre T, Rombaut D, Boussaid I, Bousta A, Guillonneau F, Perrier P, Alsafadi S, Wassef M, Margueron R, Rousseau A, Droin N, Cagnard N, Kaltenbach S, Winter S, Kubasch AS, Bouscary D, Santini V, Toma A, Hunault M, Stamatoullas A, Gyan E, Cluzeau T, Platzbecker U, Adès L, Puy H, Stern MH, Karim Z, Mayeux P, Nemeth E, Park S, Ganz T, Kautz L, Kosmider O, Fontenay M.
Sci Transl Med. 2019 Jul 10;11(500). pii: eaav5467. doi: 10.1126/scitranslmed.aav5467.