Un éclairage nouveau sur la synthèse d’un polysaccharide essentiel
Les scientifiques fournissent pour la première fois un aperçu moléculaire de la biosynthèse des chaînes d’héparanes sulfates, polysaccharides complexes de grande taille, qui ornent la surface des cellules humaines. Publiée dans la revue Nature Communications, cette étude dévoile la structure et la fonction du complexe enzymatique EXT1-EXT2 qui réalise la phase d’élongation, étape centrale de la biosynthèse des héparanes sulfates. Ces données pourraient faciliter le développement de nouvelles approches thérapeutiques pour traiter les nombreuses pathologies impliquant les ligands protéiques des héparanes sulfates, comme le cancer ou les infections virales.
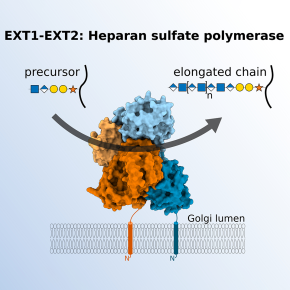
Les héparanes sulfates sont des chaînes polysaccharidiques linéaires complexes et de grande taille que l'on trouve à la surface des cellules et dans la matrice extracellulaire. Ils permettent l'interaction entre différents facteurs cellulaires et jouent ainsi un rôle important dans divers processus biologiques, comme le développement cellulaire, la signalisation et les réponses immunitaires, mais aussi dans les infections virales, bactériennes ou parasitaires. Une étape centrale de la biosynthèse des héparanes sulfates est la polymérisation du squelette glycanique, catalysée par les deux enzymes EXT1 et EXT2.
Les scientifiques ont caractérisé le complexe enzymatique EXT1 et EXT2 en combinant des analyses structurales par cryomicroscopie électronique et des essais fonctionnels. La structure tridimensionnelle de ces enzymes révèle qu’elles forment un complexe hétérodimérique étroitement associé. De manière inattendue, les sites catalytiques sont opposés l'un à l'autre, ce qui suggère que la polymérisation des chaînes est un processus non processif. Des analogues de substrats ont été préparés par synthèse chimique et ont permis une étude détaillée de l'activité enzymatique du complexe et de ses mutants. Un test cellulaire a également été établi pour étudier l'importance fonctionnelle des résidus mutés dans EXT1 et EXT2.
Ces travaux décryptent, au niveau moléculaire, le mécanisme d’élongation des chaines d'héparanes sulfates et expliquent les effets délétères des mutations observées chez les patients souffrant d'exostoses (excroissances de tissu osseux) multiples héréditaires. Ces découvertes pourraient guider le développement futur d’approches thérapeutiques visant à réguler la biosynthèse des héparanes sulfates afin de traiter le cancer et les infections virales.
Pour en savoir plus
Structure of the human heparan sulfate polymerase complex EXT1-EXT2.
Leisico F, Omeiri J, Le Narvor C, Beaudouin J, Hons M, Fenel D, Schoehn G, Couté Y, Bonnaffé D, Sadir R, Lortat-Jacob H, Wild R. Structure of the human heparan sulfate polymerase complex EXT1-EXT2. Nat Commun. 2022 Nov 19;13(1):7110. doi: https://doi.org/10.1038/s41467-022-34882-6.
PMID: 36402845; PMCID: PMC9675754.
Contact
Laboratoire
Institut de biologie structurale (CNRS/CEA/Université Grenoble Alpes)
71 rue des Martyrs
38044 GRENOBLE CEDEX 9 - France