Un baillon moléculaire de sucre pour réguler l’activité pro-tumorale de l’endosulfatase HSulf-2
Les matrices péri- et extracellulaires participent à des fonctions biologiques majeures et leur altération par des enzymes extracellulaires est associée à des pathologies, telles que le cancer. Une étude, publiée dans la revue Cell reports, montre la présence d’un polysaccharide particulier sur une sulfatase ciblant ces matrices. Son élimination rétablit l’activité de l’enzyme qui favorise alors la croissance tumorale et la formation de métastases. Ces travaux mettent en lumière un mécanisme original de régulation enzymatique et ses effets au cours de la progression tumorale.
La plupart des grands processus biologiques nécessitent un échange d’information entre la cellule et son environnement extérieur, faisant intervenir une multitude de protéines de signalisation qui transitent d’une cellule à l’autre au travers des matrices péri- et extracellulaires. Les héparanes sulfates (HS), des polysaccharides sulfatés de la famille des glycosaminoglycanes (GAGs) sont des constituants fonctionnels majeurs de ces matrices, capables de fixer et de réguler l’activité d’un très grand nombre de ces protéines de signalisation. Ces mécanismes sont très finement contrôlés, notamment par des enzymes extracellulaires qui modifient la structure des HS et leurs propriétés d’interaction. Dans certaines circonstances, l’action de ces enzymes peut conduire à des situations pathologiques. Parmi elles, une endosulfatase ciblant les HS, HSulf-2, présente une activité pro-oncogénique, démontrée notamment pour des cancers à pronostic défavorable. Cependant et malgré un intérêt croissant, les recherches menées sur cette enzyme extrêmement complexe n’ont pas permis de clarifier son mécanisme d’action.
Une collaboration internationale a été mise en place afin d’étudier les caractéristiques structurales et fonctionnelles de HSulf-2. En utilisant des approches de caractérisation biochimiques et biophysiques, les scientifiques ont identifié la présence d’une modification post-traductionnelle atypique sur l’enzyme, correspondant à une chaîne polysaccharidique de type GAG. Ils montrent que cette chaine de GAG contribue à réguler l’activité de l’enzyme en limitant sa capacité de reconnaissance de son substrat. Ainsi, l’élimination de cette chaîne de GAG (par mutation ou digestion enzymatique) accroit significativement l’activité de l’enzyme in vitro. Par ailleurs, la surexpression d’une forme d’HSulf-2 dépourvue de chaine de GAG dans des cellules de cancer mammaire favorise leur prolifération, leur migration et leur capacité d’invasion, ainsi que la croissance tumorale et l’apparition de métastases pulmonaires dans un modèle in vivo de tumeur mammaire chez la souris. Les résultats obtenus montrent enfin qu’une famille de glycosidases, les hyaluronidases, sont capables de digérer la chaine de GAG entravant HSulf-2 et ainsi de libérer son activité enzymatique. Ce processus pourrait donc expliquer la coexistence de formes de HSulf-2 porteuses ou non de chaine de GAG détectée dans plusieurs lignées cellulaires, et réguler la proportion de ces enzymes en fonction des conditions physiologiques ou pathologiques.
En conclusion, ce travail démontre la présence d’une glycosylation atypique sur la sulfatase HSulf-2, qui agit comme un modulateur non-catalytique contrôlant les propriétés pro-tumorales et pro-métastatiques de l’enzyme. Ces résultats encouragent un changement profond de paradigme, en soulignant l’importance de l'étude du degré de modification de HSulf-2 pour mieux en comprendre les fonctions biologiques.
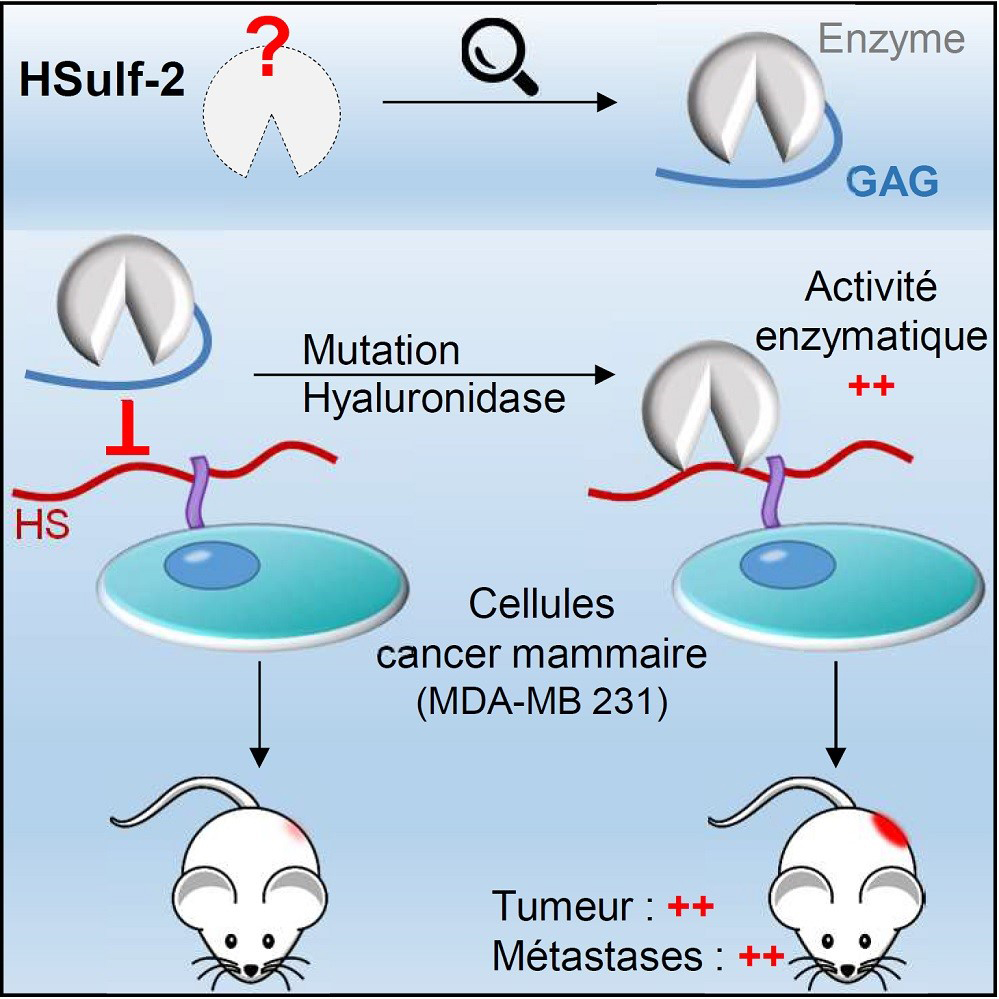
Figure : Une étude biochimique et biophysique de la sulfatase extracellulaire HSulf-2 a permis de montrer la présence d’une chaine de GAG sur l’enzyme, qui module sa capacité à fixer et à modifier les HS cellulaires. L’expression d’une forme de HSulf-2 dépourvue de GAG dans des cellules de cancer mammaire favorise la croissance tumorale et la formation de métastases.
Pour en savoir plus :
Extracellular endosulfatase Sulf-2 harbors a chondroitin/dermatan sulfate chain that modulates its enzyme activity.
El Masri R, Seffouh A, Roelants C, Seffouh I, Gout E, Pérard J, Dalonneau F, Nishitsuji K, Noborn F, Nikpour M, Larson G, Crétinon Y, Friedel-Arboleas M, Uchimura K, Daniel R, Lortat-Jacob H, Filhol O, Vivès RR.
Cell Reports 15 mars 2022. doi:10.1016/j.celrep.2022.110516.
Contact
Laboratoire
Institut de Biologie Structurale (CNRS/CEA/Université Grenoble Alpes)
71 Av. des Martyrs
38000 Grenoble