Système D chez le VIH : D pour « Dans un nouvel hôte » ?
La pandémie du SIDA est causée par le VIH-1 M qui est dérivé d’un virus de chimpanzé. Dans une étude publiée par la revue PLoS Pathogens, les scientifiques reportent qu'au cours de l’adaptation du virus à l’homme, l’enzyme virale intégrase des VIH-1 M a acquis une nouvelle fonction. Cette même fonction était, en revanche, déjà présente dans l’intégrase d’un variant mineur, le VIH-1 O, qui l’a hérité de son ancêtre, un virus infectant les gorilles. De façon surprenante, les M se sont servis de parties de la protéine différentes de celles utilisées par les O pour développer cette même fonction. Cela témoigne la diversité des chemins évolutifs suivis par les virus lors des transmissions zoonotiques. En comprendre les mécanismes sous-jacents est important pour appréhender les menaces que ces transmissions constituent pour la santé humaine.
Les souches circulantes du VIH sont subdivisées en deux types, eux-mêmes subdivisés en groupes, sur la base de leur diversité génétique. La pandémie est essentiellement due au type 1, plus particulièrement au groupe M et, dans une moindre mesure, au groupe O. Les VIH-1 M sont dérivés des virus infectant les chimpanzés, et les VIH-1 O des virus infectant les gorilles. Malgré ces origines bien différentes, les deux virus semblent avoir parcouru des chemins évolutifs convergents chez l’homme, portant à deux variantes du VIH-1 aux caractéristiques presque indistinguables. Il est couramment admis que l’infection par ces deux virus soit assurée par des protéines homologues et donc aux fonctionnements très similaires.
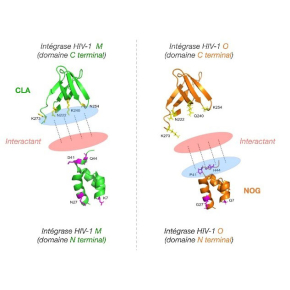
L’intégrase est l’enzyme virale responsable de l’insertion du génome du virus dans celui de la cellule (intégration). Dans les virus du groupe M, nous avons identifié, par des expériences en culture cellulaire, un motif fonctionnel essentiel pour l’intégration : le motif CLA (région « C terminal »). Tous les VIH-1 M ont la même séquence en acide aminés sur ce motif, indiquant qu’un fort avantage est conféré par cette séquence. En revanche, dans les intégrases du groupe O, ce motif n’est pas retrouvé, et sa fonction est assurée par un autre motif (NOG), possédant une séquence d’acides aminés conservés dans tous les isolats O et absent des isolats M., Ce motif spécifique des O, en plus, est situé dans une autre région de la protéine. Cette dichotomie fonctionnelle entre protéines homologues est surprenante, mais elle peut être en partie expliquée par les origines différentes des deux groupes de VIH-1. Le motif NOG, qui est déjà présent chez les virus infectant les gorilles, a vraisemblablement été hérité par le VIH-1 O de son ancêtre. Le motif CLA, cependant, ne peut pas avoir été hérité par le VIH-1 M de son ancêtre, car dans la région correspondante chez les virus infectant les chimpanzés nous retrouvons des acides aminés semblables, mais pas de conservation de séquence. Cela suggère que le motif n‘est pas requis dans cet hôte, ce qui, en revanche, semblerait être le cas chez l’homme. Cette nécessité, spécifique à l’homme, serait à l’origine de la sélection du motif CLA lors de l’évolution du virus dans son nouvel hôte.
Chez les virus, la nécessité de compacité des génomes amène souvent à l’émergence de protéines multifonctionnelles ou, a minima, très optimisées dans leurs fonctions, grâce à la contribution de différents motifs fonctionnels. L’intégrase est une de ces protéines. La présence du motif NOG chez le VIH-1 O dès son transfert à l’homme, suggère que la région de la protéine où émergera le motif CLA chez le VIH-1 M, n’était pas soumise à cette pression de sélection dans les O et elle aurait pu avoir évolué pour remplir une autre fonction. Les scientifiques ne peuvent pas dire si ce processus a été entrepris ni s’il a abouti, mais il semblerait que, en arrière-plan de l’instantanée prise pour retracer l’évolution d’une protéine dans le contexte de la transmission zoonotique, ils auraient peut-être capté une étape intermédiaire de l’acquisition d’une fonctionnalité additionnelle de cette protéine.
Lors de l’infection d’une nouvelle espèce, un virus fait face à un changement d’environnement drastique. L’adaptation à ce dernier, demande une accélération de son évolution. Une compréhension approfondie des mécanismes évolutifs auquel le virus fait appel dans ce cas est donc important pour appréhender la menace pour notre santé qu’est la transmission de virus animaux à l’homme.
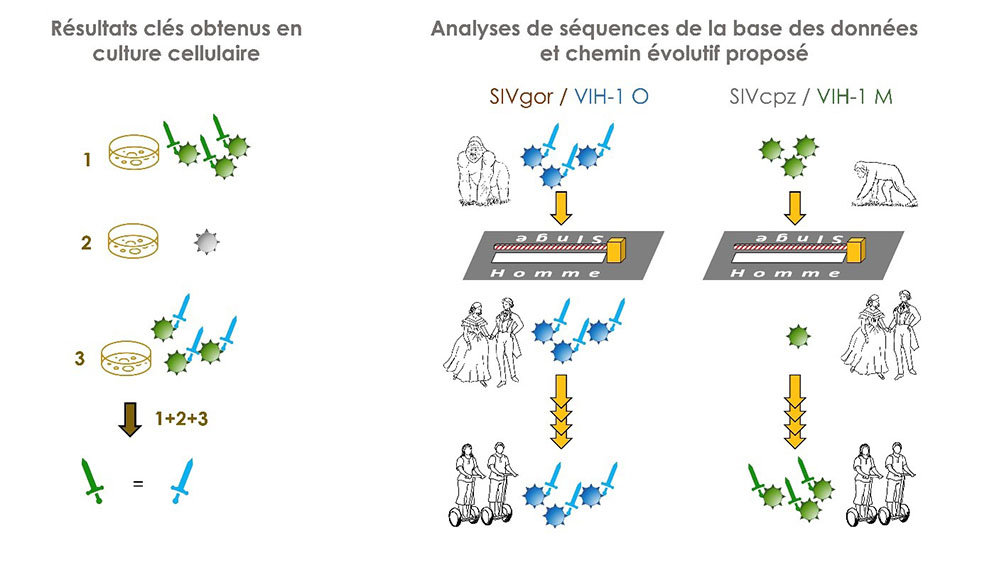
Figure : A gauche, les résultats obtenus en culture cellulaire montrent que l’infectivité (schématisée par le nombre de virus) des VIH-1 M est totalement abolie (virion gris) si on enlève le motif fonctionnel CLA (épée verte) mais elle est restaurée par l’insertion du motif NOG (épée bleue) des isolats HIV-1 O. A droite, l’analyse des séquences des motifs CLA et NOG circulants montre que le motif NOG a été hérité par les VIH-1 O par son ancêtre (un virus infectant le gorille) alors que le motif CLA (chez les VIH-1 M a été sélectionné après l’infection de l’homme de la part du virus infectant les chimpanzés.
Pour en savoir plus :
A snapshot on HIV-1 evolution through the identification of phylogenetic-specific properties of HIV-1 integrases M/O.
Elenia Toccafondi, Marine Kanja, Flore Winter, Daniela Lener and Matteo Negroni
PLoS Pathog 19(3) : e1011207. DOI : http://doi.org/10.1371/journal.ppat.1011207
Contact
Laboratoire
Architecture et réactivité de l’ARN (CNRS / Université de Strasbourg)
Laboratoire Rétrovirus et évolution moléculaire
Institut de biologie moléculaire et cellulaire - IBMC
2 Allée Konrad Roentgen
67084 Strasbourg