Sans CYLD, les satellites (centriolaires) ne répondent plus
Les satellites centriolaires sont de petites structures granulaires qui gravitent autour du centrosome et autorisent la formation du cil primaire. Cette étude parue dans Cell Reports, révèle un nouveau mécanisme de contrôle de l’homéostasie des satellites centriolaires. Celui-ci repose sur le contrôle fin de l’ubiquitination de certains composants de ces structures. Cette découverte ouvre de nouvelles perspectives sur la compréhension des mécanismes qui régissent la ciliogenèse.
Les ciliopathies sont des maladies génétiques qui se caractérisent par une large panoplie de symptômes : polydactylie, malformations cérébrales, dystrophie rétinienne, fibrose hépatique et maladies rénales. Ces syndromes sont causés par des dysfonctionnements dans la formation d’une petite organelle qui apparaît à la surface de la plupart des cellules mammifères, appelée cil primaire. Le cil primaire, érigé comme une petite antenne, exerce un rôle essentiel pour l’intégration et la transmission de signaux avec l’environnement extracellulaire.
La ciliogenèse est un processus complexe hautement régulé, dont les effecteurs restent mal caractérisés. C’est le cas de CYLD, une protéase capable d’hydrolyser les chaines d’ubiquitine qui décorent des substrats pour en modifier le destin, essentielle pour la formation du cil primaire.
Afin de découvrir de nouveaux partenaires de CYLD, les chercheurs ont analysé son interactome par spectrométrie de masse dans un modèle de cellules épithéliales de rétine (RPE-1), classiquement utilisé dans l’étude de la ciliogenèse. Ceci a permis l’identification d’un groupe de protéines qui s’organisent en granules et gravitent autour des centrosomes, appelées satellites centriolaires. Des mutations dans certains gènes codant pour ces éléments entraînent des défauts de ciliogenèse et causent des ciliopathies. En combinant des expériences de microscopie à super-résolution à de la biochimie des protéines, ils ont montré qu’une portion de CYLD s’accumule au niveau des satellites centriolaires. Là, CYLD contrecarre l’action d’un « déstabilisateur » des satellites en lui ôtant spécifiquement des chaînes d’ubiquitine et maintient ainsi l’intégrité de ces structures.
Ces résultats illustrent le rôle crucial de l’ubiquitination dans le contrôle de l’architecture des satellites centriolaires et améliorent la compréhension des mécanismes qui régulent la formation du cil primaire.
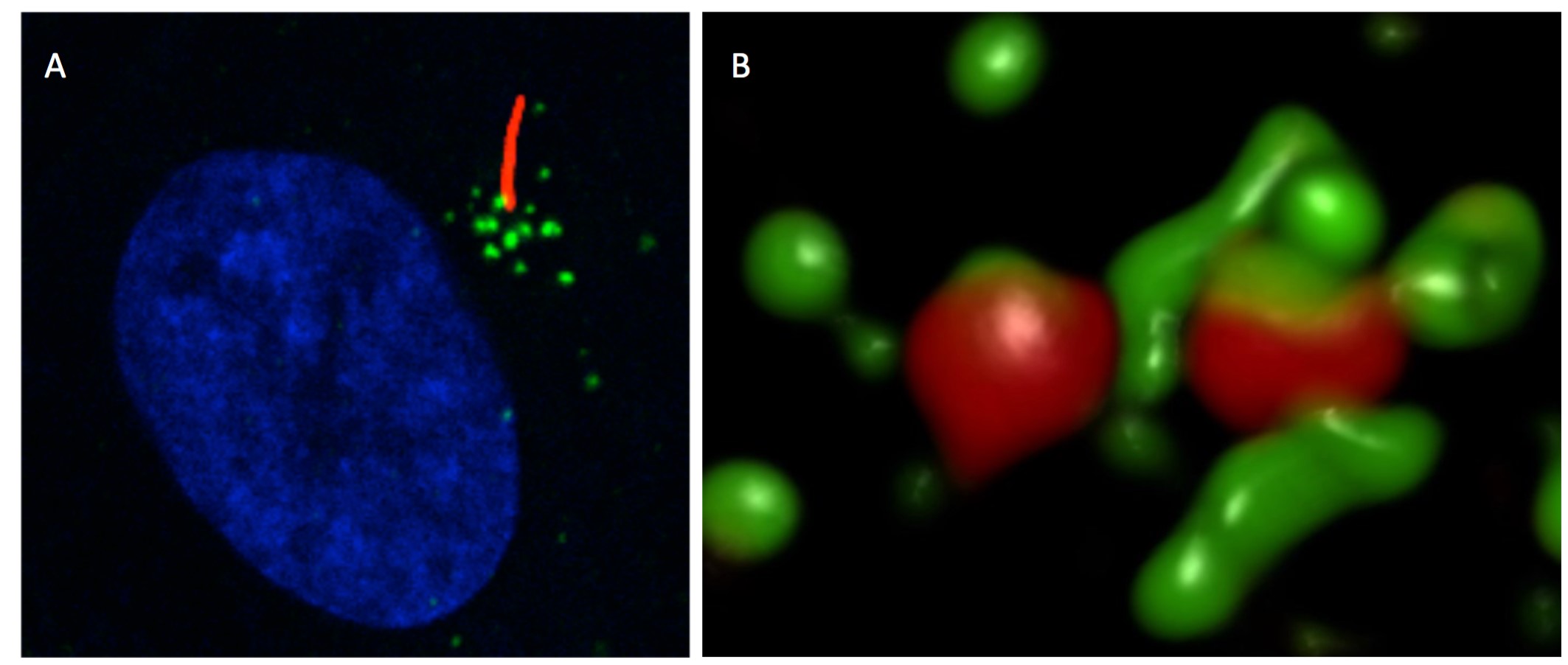
© Tiphaine Douanne
Pour en savoir plus :
CYLD Regulates Centriolar Satellites Proteostasis by Counteracting the E3 Ligase MIB1.
Douanne T, André-Grégoire G, Thys A, Trillet K, Gavard J, Bidère N.
Cell Rep. 2019 May 7;27(6):1657-1665.e4. doi: 10.1016/j.celrep.2019.04.036.
