Rhs : une grenade antibactérienne
Certaines bactéries utilisent un système d’injection contractile pour propulser des effecteurs dans une cellule cible. Le système de sécrétion de type VI permet ainsi d’envoyer une micro-flèche transportant des toxines dans des bactéries compétitrices afin de les éliminer et d’avoir un accès privilégié aux ressources de l’environnement. Les scientifiques ont identifié une nouvelle toxine, qui modifie l’ARN 23S du ribosome, bloquant ainsi la synthèse protéique. Cette toxine est enfermée dans une capsule ressemblant à une grenade fixée à l’extrémité de la micro-flèche. Ces résultats sont publiés dans les revues Nucleic Acids Research et Nature Communications.
Les bactéries ont développé de nombreuses stratégies pour communiquer entre elles, et pour échanger des informations et des nutriments. Cependant, lorsque les ressources deviennent limitantes, elles assemblent des armes sophistiquées qui leur permettent de se combattre. L’une de ces armes, le système de sécrétion de type VI (SST6) ressemble à un harpon miniature. Une flèche est assemblée et positionnée vers l’extérieur de la cellule. Cette flèche est entourée pour une gaine contractile agissant comme un ressort. Assemblée sous forme étendue, sa contraction permet de propulser la flèche dans la cellule cible. Cette flèche transporte également des toxines dont l’activité vont permettre de tuer la cellule cible. Parmi les toxines caractérisées, on retrouve des enzymes qui dégradent le peptidoglycane, les phospholipides des membranes, ou l’ADN.
En étudiant une toxine de fonction inconnue de la bactérie Photorhabdus luminescens, les scientifiques ont montré qu’elle bloquait la traduction des protéines. Des expériences supplémentaires ont permis de déterminer que cette toxine arrêtait la synthèse protéique en transférant un groupe ADP-ribose du cofacteur NADH sur le ribosome, et plus spécifiquement sur une base de l’ARN ribosomique 23S impliquée dans l’activation des facteurs d’élongation.
Cette toxine, baptisée Tre23 (Type VI ribosyltransferase effector targeting 23S ribosomal RNA), est en fait le domaine C-terminal d’une très large protéine, appelée Rhs, faisant partie de la famille des toxines polymorphiques. Outre ce domaine C-terminal correspondant à l’activité toxique, le domaine N-terminal de la toxine permet son transport et, comme des expériences de purification l'ont montré, assure l’accrochage à la pointe de la flèche du SST6.
Les chercheurs ont résolu la structure de la protéine Rhs par cryo-microscopie électronique, révélant qu’elle se repliait sous la forme d’un tonneau fermé de part et d’autre, et enfermant la toxine. La toxine est donc "encapsulée" pendant son transport. Cependant, une fois Rhs arrivée dans la cellule cible, deux acides aminés (acides aspartiques), localisés de chaque côté du tonneau, catalysent une réaction d’auto-clivage permettant de faire sauter les deux fonds du tonneau, libérant la toxine. Ce mécanisme est comparable à une grenade, qui nécessite d’être dégoupillée pour exploser.
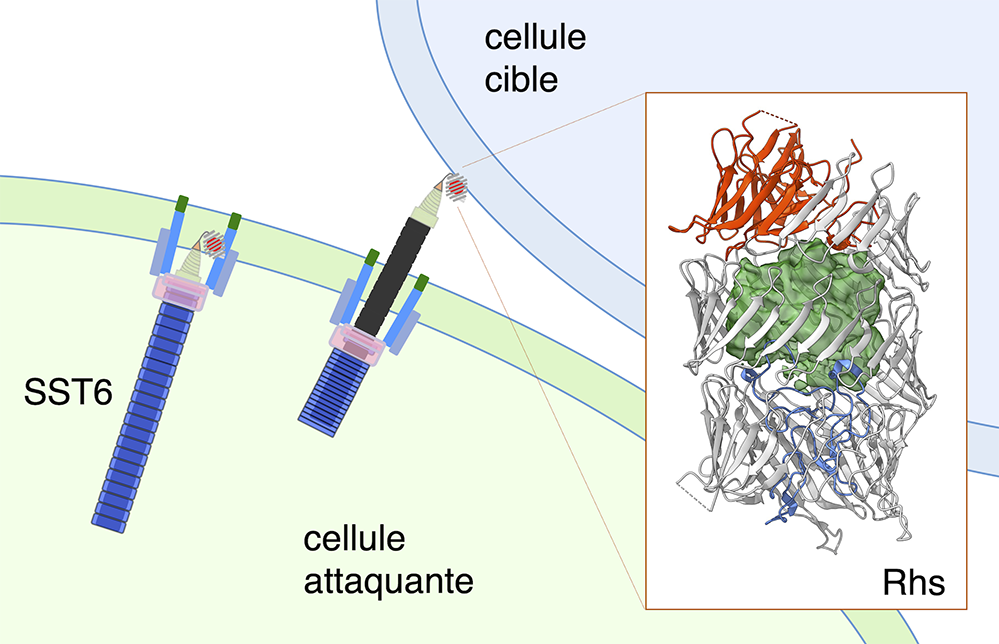
Figure : Mécanisme de transport et structure de la toxine polymorphique Rhs. Le système de sécrétion de type VI (SST6) assemble une gaine contractile (bleue) qui propulse une microflèche (noire) dans la cellule cible. La protéine Rhs est attachée sur la pointe de l’aiguille de la flèche, permettant son injection dans la cible. La région centrale de la protéine Rhs se replie sous forme de tonneau (gris), fermé des deux côtés (couvercles bleu et rouge), et encapsulant le domaine toxique, qui sera libéré dans la cible (densité verte).
Pour en savoir plus :
Photorhabdus antibacterial Rhs polymorphic toxin inhibits translation through ADP-ribosylation of 23S ribosomal RNA.
Jurėnas D, Payelleville A, Roghanian M, Turnbull KJ, Givaudan A, Brillard J, Hauryliuk V, Cascales E.
Nucleic Acids Research 13 juillet 2021. https://doi.org/10.1093/nar/gkab608
Mounting, structure and autocleavage of a type VI secretion-associated Rhs polymorphic toxin.
Jurėnas D, Talachio Rosa L, Rey M, Chamot-Rooke J, Fronzes R, Cascales E.
Nat Communications. 1er décembre 2021. https://doi.org/10.1038/s41467-021-27388-0
Contact
laboratoires
Laboratoire d’Ingénierie des Systèmes Macromoléculaires
Institut de Microbiologie de la Méditerranée (CNRS, Aix-Marseille Université)
31 Chemin Joseph Aiguier
13009 Marseille, France
Microbiologie Fondamentale et Pathogénicité
Institut Européen de Chimie et Biologie (CNRS, Université de Bordeaux)
2 rue Robert Escarpit
33600 Pessac, France
