Retracer l’origine des réponses T-indépendantes chez l’homme
Les réponses anticorps T-indépendantes ciblent essentiellement les glycanes constituant la capsule de bactéries pathogènes comme le pneumocoque Streptococcus pneumoniae. Elles sont importantes dans la protection contre les infections dues aux bactéries encapsulées. Dans un article publié dans Science Immunology, les scientifiques ont identifié les cellules B impliquées dans ces réponses et montré qu’elles sont préactivées dans les tissus lymphoïdes associés à l'intestin lors de réponses dirigées contre les glycanes présents à la surface des bactéries de la flore intestinale.
Les lymphocytes B ont la capacité de se différencier en plasmocytes sécrétant des anticorps de classe IgM, IgA et IgG en réponse à des antigènes exprimés par des microorganismes pathogènes tels que les bactéries, virus…. Selon la nature de l’antigène, on distingue les réponses T-dépendantes (TD) et T-indépendantes (TI). Ces dernières ciblent des structures répétées telles que les glycanes constituant la capsule de certaines bactéries, comme le pneumocoque. Les réponses TD sont caractérisées par la formation de centres germinatifs dans les organes et tissus lymphoïdes (en particulier ceux associés à l’intestin appelés « GALTs ») et par la production de lymphocytes B mémoires. Au sein des centres germinatifs, le mécanisme d’hypermutation somatique ciblant les gènes des anticorps est activé. Il permet aux lymphocytes B de produire des anticorps mutés de haute affinité pour l’antigène qu’ils reconnaissent. Les réponses TI, quant à elles, n’induisent pas la formation de centres germinatifs et de lymphocytes B mémoires. Or, les anticorps produits contre les polysaccharidiques de la capsule de différents types de pneumocoques sont mutés chez l’homme. On distingue différentes populations de lymphocytes B, en particulier les lymphocytes « MZ-B », pour lesquelles un rôle dans les réponses TI a été proposé chez l’homme, mais pas formellement prouvé. Les scientifiques ont donc cherché à déterminer l’origine des réponses TI, en utilisant des méthodes de séquençage haut débit du répertoire des anticorps qui sont exprimés à la surface des lymphocytes B. Ils ont ainsi étudié différentes sous-populations de lymphocytes B présentes dans le sang d’individus sains, avant et après vaccination avec le vaccin Pneumovax, composé de polysaccharides capsulaires de 23 sérotypes de pneumocoque. Chaque lymphocyte B porte une signature moléculaire unique, ce qui permet de tracer sa filiation et d’identifier des clones de lymphocytes B (un clone étant composé de cellules qui descendent tous d’une même cellule ancestrale). Dans le sang des individus vaccinés, les scientifiques ont montré qu’à jour 7 après vaccination, la réponse plasmocytaire mobilise de très grands clones, incluant toujours des cellules IgM+ et exprimant des anticorps mutés. Ces grands clones plasmocytaires sont majoritairement en filiation avec des clones de lymphocytes B préexistants dans le sang avant la vaccination, ces clones étant déjà mutés et composés de lymphocytes MZ-B IgM+, mais aussi de lymphocytes IgA+ et plus rarement IgG+. Les anticorps produits par ces grands clones plasmocytaires reconnaissent de façon spécifique les polysaccharides pneumocoquaux du Pneumovax mais sont également capables de se lier à des bactéries de la flore intestinale. Cette réactivité dite « croisée » étant très probablement dirigée contre des glycanes présent à la surface des bactéries de l’intestin. Il est à noter que lorsque les anticorps sont exprimés sous leur forme native dite « germinale », (c’est-à-dire celle présente avant l’acquisition de mutations somatiques), la réactivité contre les polysaccharides pneumocoquaux est perdue, mais la reconnaissance de bactéries de la flore intestinale est généralement conservée. Il a été récemment rapporté que les précurseurs des lymphocytes MZ-B se différencient et mutent leurs anticorps membranaires dans les centres germinatifs des GALTs chez l’homme.
En se basant sur ces travaux et des données de la littérature, les scientifiques proposent ici que les lymphocytes MZ-B mutent (ou pré-diversifient) leurs anticorps membranaires dans les GALTs, au cours d’un processus orchestré par les bactéries de la flore commensale, et ciblant des glycanes qu’elles expriment à leur surface. Ceci permet d’élaborer un compartiment de lymphocytes B dans le sang, incluant à la fois des lymphocytes MZ-B IgM+ et de lymphocytes IgA+ et IgG2+ clonalement reliées, et ayant la capacité de réagir de manière croisée avec les glycanes de bactéries capsulées pathogènes. Un moyen pour pouvoir produire en un temps très court des anticorps mutés contre des bactéries encapsulées hautement pathogènes (méningocoque, Haemophilus influenzae, pneumocoque etc.).
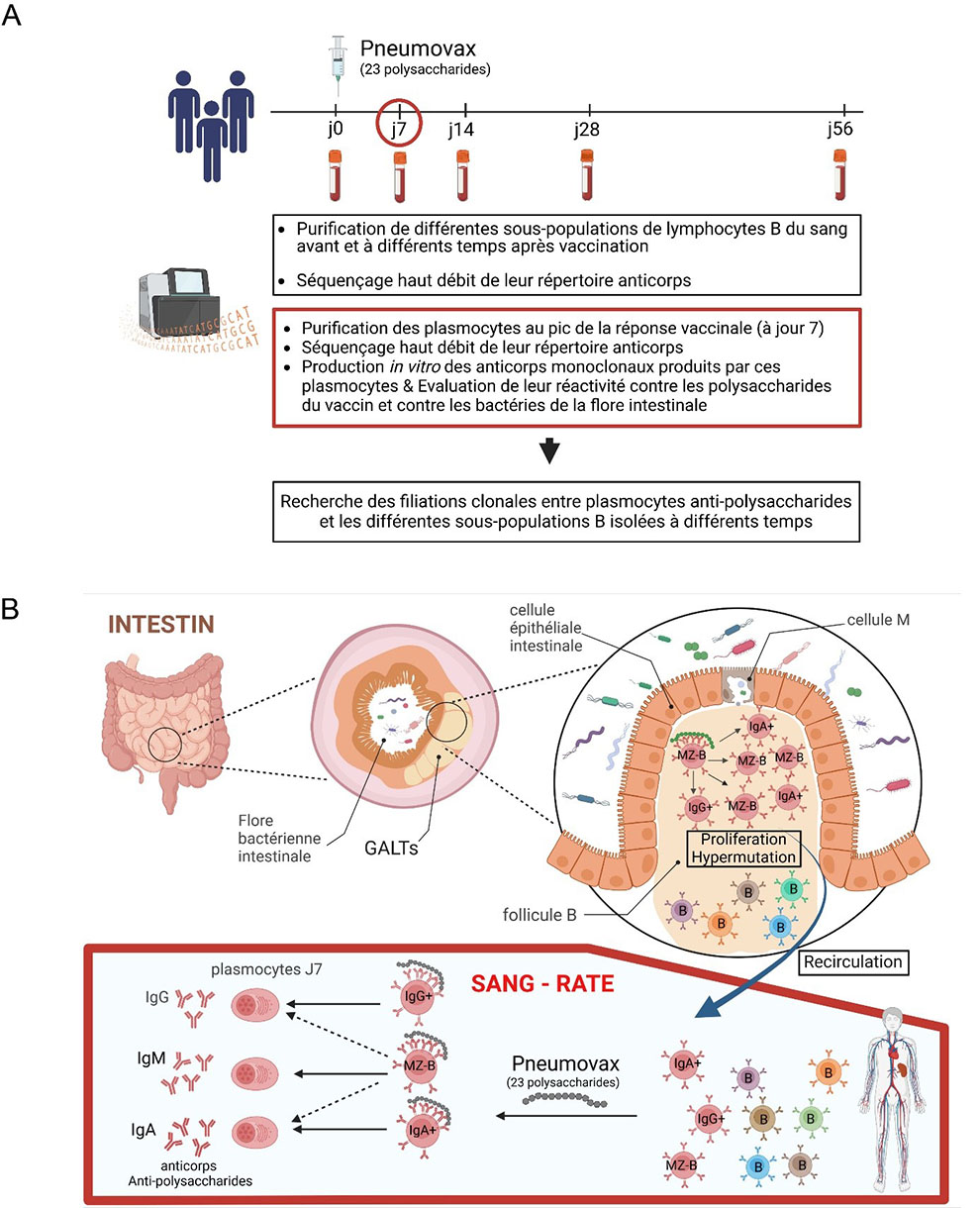
Figure :
A. Stratégies expérimentales
B. Résumé graphique. Les tissus lymphoïdes associés à l’intestin (GALTs) comportent des follicules B, riches en cellules B. Les cellules « M » sont des cellules épithéliales spécialisées, associées à ces follicules, capables d’échantillonner les antigènes bactériens présents dans l’intestin. Les résultats de l’étude suggèrent qu’une cellule MZ-B qui reconnait des antigènes bactériens polysaccharidiques (grâce à ses anticorps de surface) va pouvoir être activée, enclencher le mécanisme d’hypermutation ciblant les gènes codant pour ses anticorps et se mettre à proliférer, en donnant ainsi naissance à un clone de cellules B. Au cours de cette activation, certaines des cellules filles vont subir la commutation isotypique leur permettant de passer de l’expression d’un anticorps de surface de type IgM à un anticorps de type IgG ou IgA. Les cellules B des GALTs peuvent recirculer dans le sang et la rate. Lors de la vaccination avec le Pneumovax, les cellules B pré-activées et pré-mutées dans les GALTS et dont les anticorps réagissent de manière croisée avec les glycanes du Pneumovax vont être activées et se différencier en plasmocytes produisant des anticorps mutés.
Pour en savoir plus :
T-independent responses to polysaccharides in humans mobilize marginal zone B cells prediversified against gut bacterial antigens
S. Weller, D. Sterlin, T. Fadeev, E. Coignard, A. Verge De Los Aires, C. Goetz, R. Fritzen, M. Bahuaud, F. Batteux, G. Gorochov, J-C. Weill and C-A. Reynaud
Science Immunology, 27 janvier 2023. DOI : 10.1126/sciimmunol.ade1413
Contact
Laboratoire
Institut Necker - enfants malades (Université Paris Cité/Inserm/CNRS)
156-160, rue de Vaugirard
75015 Paris
