Quand une protéine de l’immunité protège notre patrimoine génétique
Dans un article publié dans Nucleic Acids Research, des scientifiques ont découvert que NLRP3, une protéine connue pour protéger l’organisme lors d’une infection, joue un rôle essentiel dans la réparation de l’ADN. En effet, la perte de NLRP3 altère la capacité des cellules à réparer l’ADN lorsque ce dernier subit des cassures double brin. Cela entraîne des dommages toxiques pour la cellule, ce qui constitue un facteur favorisant l’émergence de cellules tumorales.
L’ADN sous menace constante : un équilibre à préserver
Maintenir l’intégrité de notre patrimoine génétique est essentiel pour la survie de nos cellules. En effet, notre ADN est constamment exposé à des agressions, qu’elles soient externes, telles que les rayonnements UV ou internes, liées au fonctionnement normal de nos cellules.
Parmi les lésions les plus délétères figurent les cassures double brin de l’ADN, c’est-à-dire lorsque les deux brins de la molécule d’ADN sont coupés. Si elles ne sont pas réparées correctement, ces cassures peuvent entraîner des erreurs dans l’ADN, appelées mutations, et favoriser l’apparition de cancers.
Pour contrer ces dommages, nos cellules disposent de mécanismes de réparation sophistiqués. Deux voies principales interviennent pour réparer les cassures double-brin : la jonction des extrémités non homologues (NHEJ) et la recombinaison homologue (RH). Cette dernière, considérée comme la plus fidèle, car elle permet une restauration sans erreur de la séquence d’ADN, nécessite toutefois une étape préalable appelée « résection », où un des deux brins est excisé pour amorcer le processus de réparation. Certains acteurs de la voie NHEJ, comme la protéine REV7, composante du complexe Shieldin, peuvent inhiber cette étape, limitant ainsi l’efficacité de la RH.
NLRP3 : une fonction inédite dans la réparation de l’ADN
Dans une étude publiée dans la revue Nucleic Acids Research, des scientifiques ont identifié une fonction jusque-là inconnue de NLRP3, une protéine classiquement associée à la réponse immunitaire. Leur recherche montre que la suppression de l’expression de NLRP3 altère la réparation des cassures double-brin en réduisant l’efficacité de la recombinaison homologue. NLRP3 agit en facilitant la résection de l’ADN, indépendamment de sa fonction dans la réponse immunitaire. Son absence rend les cellules sensibles aux inhibiteurs de PARP (PARPi), des agents thérapeutiques utilisés notamment dans le traitement des cancers du sein triple négatif et du cancer de l’ovaire.
Sur le plan mécanistique, les scientifiques ont mis en évidence une interaction directe entre NLRP3 et REV7, empêchant cette dernière d’inhiber la recombinaison homologue. Enfin, ils démontrent que la double inactivation de NLRP3 et de REV7 restaure la voie de recombinaison homologue et confère une résistance aux PARPi, un phénomène analogue à celui observé dans les cellules cancéreuses portant des mutations dans le gène clé de la recombinaison homologue BRCA1.
Cette étude révèle ainsi un rôle inédit de NLRP3 dans la réparation de l’ADN, bien au-delà de son rôle connu dans l’immunité. Elle montre que cette protéine oriente la réparation vers la voie la plus fidèle dans le but de maintenir l’intégrité de notre patrimoine génétique afin de prévenir l’accumulation de mutations et le développement de cancers.
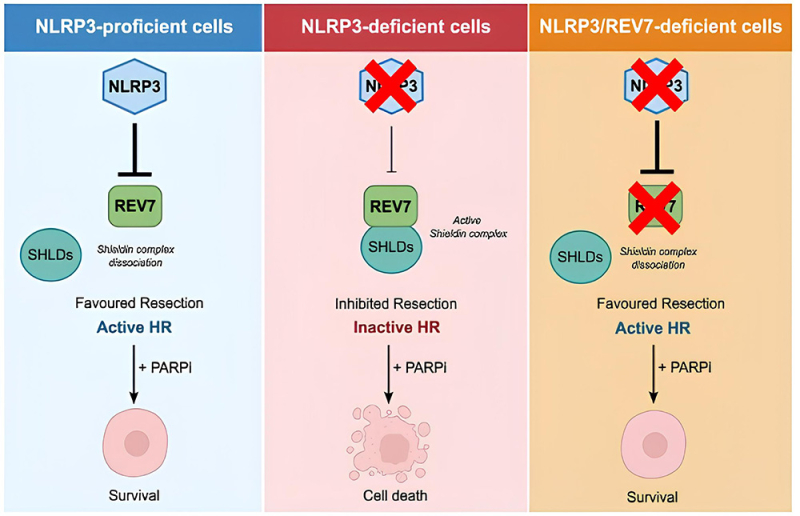
Figure : En présence de cassures double brin de l’ADN, NLRP3 oriente la réparation des cassures vers la voie de la recombinaison homologue (RH) en se liant au facteur REV7, une sous-unité du complexe shieldin, inhibiteur de la voie RH. Les cellules sont donc compétentes en RH et ne sont pas sensibles aux PARPi. En absence de NLRP3, REV7 est libre de former le complexe shieldin qui exerce son action inhibitrice sur la voie RH, les cellules sont alors sensibles aux PARPi. En l’absence de NLRP3 et REV7, la voie RH est rétablie, et les cellules deviennent résistantes aux PARPi.
En savoir plus : Delphine Burlet, Md Muntaz Khan, Sabine Hacot, Hannes Buthmann, Léa Bardoulet, Anne-Laure Huber, Julie Gorry, Bastian Föhr, Bernard S Lopez, Yohann Couté, Alex C Faesen, Matthias Geyer, Agnès Tissier, Virginie Petrilli, The inflammasome sensor NLRP3 interacts with REV7 to maintain genome integrity through homologous recombination, Nucleic Acids Research, Volume 53, Issue 12, 8 July 2025, gkaf554, https://doi.org/10.1093/nar/gkaf554
Contact
Laboratoire
Centre de recherche en cancérologie de Lyon - CRCL (Centre anticancéreux Léon Bérard/CNRS/Inserm/Université Claude Bernard)
28 rue Laënnec
69008 Lyon