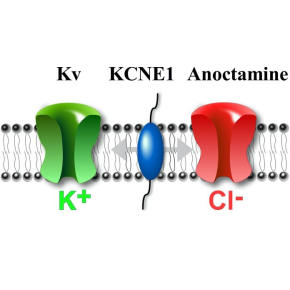
Quand un canal en cache un autre
Les canaux ioniques créent les signaux électriques avec lesquels le cœur bat, les muscles se contractent et le système nerveux ressent le monde, intègre l’information, crée la mémoire et contrôle le comportement. Leur dysfonctionnement est associé à des pathologies allant de la migraine à l’arythmie cardiaque. Une étude vient de démontrer un assemblage inédit entre deux superfamilles distinctes de canaux ioniques ouvrant des perspectives dans les traitements des arythmies cardiaques et également du syndrome des yeux secs. Les résultats sont publiés dans la revue Cell.
Les canaux ioniques sont des microgénérateurs de courant. Ce sont des complexes protéiques constitués de sous-unités α qui forment le « pore » du canal par lequel transitent les ions et de sous-unités dites auxiliaires (β) régulatrices associées. Les mutations génétiques affectant les sous-unités α et β régulatrices sont fréquemment associées à diverses maladies, appelées canalopathies, telles que la migraine, les arythmies cardiaques ou encore l’épilepsie. Il est admis que les sous-unités α et β s’associent de façon spécifique pour donner un seul type de canal. Cet article remet ce dogme en question.
La sous-unité α, pore du canal KCNQ1 qui appartient à la superfamille des canaux voltage-dépendants, s’associe à la sous-unité β-KCNE1 pour générer le courant potassique « Iks » dont le dysfonctionnement induit des arythmies cardiaques. La grande majorité des mutations affectant KCNE1, de façon similaire à celle affectant KCNQ1, induisent une perte du courant potassique expliquant son implication dans la pathologie. Cependant, certaines mutations de la sous-unité β-KCNE1 n’ont aucun effet sur le courant potassique cardiaque laissant penser à un rôle supplémentaire de KCNE1.
30 ans après sa découverte, les scientifiques montrent que KCNE1 est également une sous-unité auxiliaire régulatrice β des canaux chlore Anoctamine. KCNE1 en s’associant avec cette famille de canaux induit la formation d’un courant chlore régulé par l’hormone angiotensine II qui contrôle la pression artérielle. En outre, cette étude révéle que certaines mutations de KCNE1, associées à des pathologies, n’ont aucun effet sur le courant potassique mais inhibent complétement le courant chlore. Ce résultat constitue donc une nouvelle cible pour le traitement des arythmies cardiaques. Cette étude fait l’objet d’un brevet (EP20305795.5) concernant la mise au point d’une nouvelle drogue induisant la sécrétion cellulaire d’eau utile à terme pour le traitement de pathologies telles que la mucoviscidose ou encore le syndrome des yeux secs.
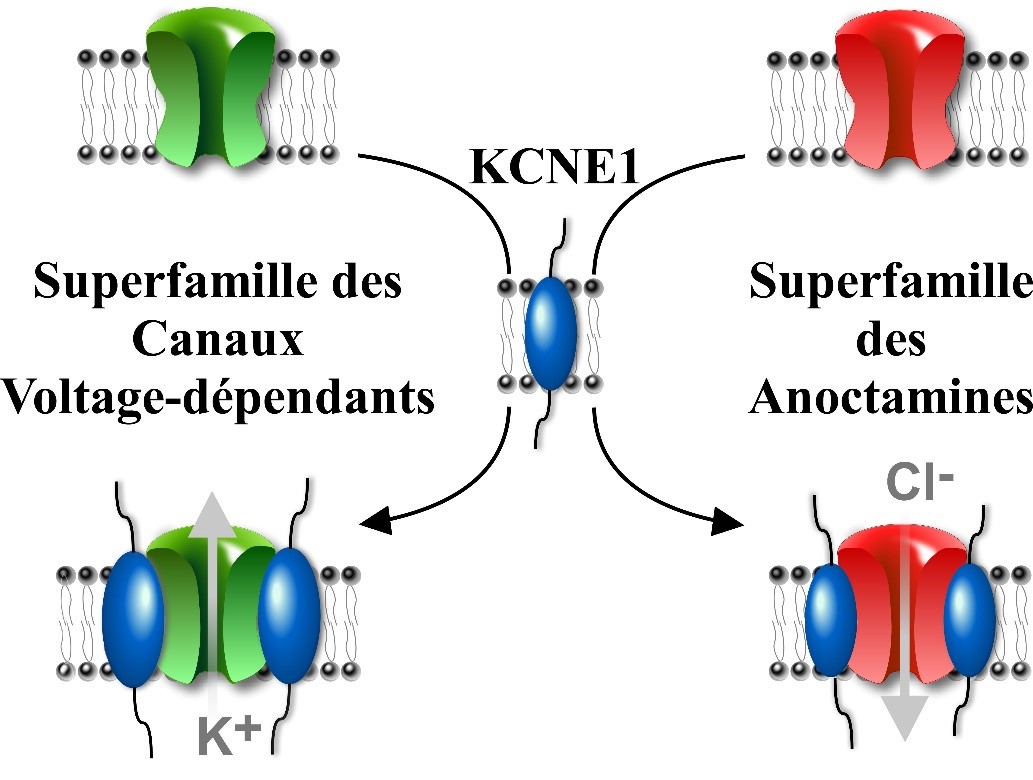
Figure : La sous-unité β-KCNE1 est une sous-unité auxiliaire régulatrice de deux superfamilles de protéines, qui ne sont pas phylogénétiquement reliées, les canaux voltage-dépendant et les canaux chlore Anoctamine.
En savoir plus
KCNE1 is an auxiliary subunit of two distinct ion channel superfamilies.
Avalos Prado P , Häfner S, Comoglio Y, Wdziekonski B, Duranton C, Attali B, Barhanin J, Sandoz G.
Cell, 28 Dec. 2020. DOI: https://doi.org/10.1016/j.cell.2020.11.047
Contact
Laboratoire
Institut de biologie Valrose (iBV) - (CNRS / Inserm / Université Côté d'Azur)
UNIVERSITE NICE SOPHIA ANTIPOLIS
06108 NICE CEDEX 2