Quand retirer une étiquette de l’ADN stoppe la croissance tumorale
Chez les mammifères, la méthylation de l’ADN est une petite modification chimique qui agit comme une étiquette sur certaines bases de l’ADN, les cytosines. Elle n’altère pas la séquence mais participe au contrôle de l’activité des gènes et la stabilité du génome. Dans un article publié dans la revue Nature Communications, des scientifiques montrent que la méthylation de l’ADN agit comme un « bouclier » qui protège les cellules cancéreuses. La bloquer sans abimer l’ADN force les cellules cancéreuses à arrêter leur division.
Méthylation de l’ADN et cellules cancéreuses
Chez les mammifères, la méthylation de l’ADN est une petite modification chimique qui agit comme une étiquette sur certaines bases de l’ADN, les cytosines. Elle n’altère pas la séquence mais participe au contrôle de l’activité des gènes et la stabilité du génome.
Lorsqu’une cellule copie son ADN, ce motif de méthylation est fidèlement reproduit grâce à deux protéines : DNMT1, qui ajoute un groupement méthyle sur la cytosine et UHRF1, qui active DNMT1.
Dans les cellules cancéreuses, la méthylation est souvent déréglée et constitue en conséquence une cible thérapeutique. Une molécule utilisée comme médicament, la 5-aza-deoxycytidine, bloque DNMT1. Mais elle provoque aussi des dommages de l’ADN. On ne savait donc pas si ces effets antitumoraux venaient uniquement de la perte de méthylation.
Les conséquences d’une déméthylation contrôlée
Pour élucider cette question, dans une étude publiée dans la revue Nature Communications, des scientifiques ont, grâce à un outil génétique appelé dégron, supprimé spécifiquement les protéines DNMT1 et UHRF1 dans diverses lignées cellulaires tumorales. En supprimant ces protéines, ils ont provoqué une déméthylation rapide de l’ADN sans l’endommager.
Dans ces conditions, les cellules cancéreuses ont manifesté les symptômes typiques de la sénescence cellulaire : arrêt définitif de la division cellulaire, augmentation de la taille des cellules et des noyaux, et sécrétion de molécules inflammatoires (phénotype SASP). Ce phénomène a été étudié dans des cellules de cancer colorectal mais a été également observé dans des cellules représentant plusieurs autres types de cancers (poumon, sein, col de l’utérus, os).
Des analyses plus fines ont révélé que cette sénescence ne dépend pas des voies classiques impliquant les protéines p53 ou Rb mais implique une autre protéine nommée cGAS, dans un rôle inhabituel.
Des expériences de xénogreffes chez la souris, qui consiste à injecter des cellules tumorales, démontrent que la dégradation de DNMT1 ou UHRF1 dans les tumeurs, provoque une déméthylation de l'ADN qui s'accompagne de sénescence, laquelle diminue la croissance tumorale et stimule la réponse immunitaire anti-tumorale. Certains aspects importants du mécanisme restent à éclaircir à l'avenir.
En résumé, la méthylation de l’ADN agit comme un « bouclier » protégeant les cellules cancéreuses. L’enlever, sans abimer l’ADN force les cellules à arrêter leurs divisions.
Ces travaux désignent également UHRF1 comme nouvelle cible potentielle et ouvrent la voie à l’étude de traitement combinant inhibition de la méthylation et thérapies sénolytiques (qui détruisent les cellules sénescentes). De futures recherches préciseront ces stratégies.
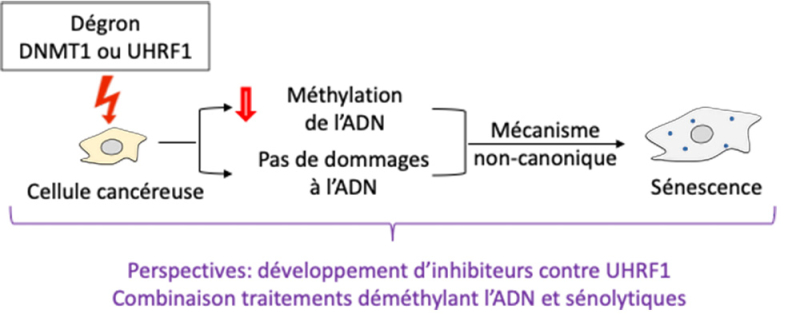
Figure: Le travail effectué sur cellules cancéreuses permet de séparer déméthylation de l'ADN et dommages à l'ADN. Il montre que la déméthylation de l'ADN, en elle-même, provoque la sénescence des cellules cancéreuses par un mécanisme non-canonique. Il établit l'intérêt de rechercher des inhibiteurs de UHRF1, et montre l'intérêt potentiel de coupler traitement déméthylant et traitement sénolytique. Résumé des résultats publiés par Chen et al.
En savoir plus : Chen, X., Yamaguchi, K., Rodgers, B. et al. DNA methylation protects cancer cells against senescence. Nat Commun 16, 5901 (2025). https://doi-org.insb.bib.cnrs.fr/10.1038/s41467-025-61157-7
Contact
Laboratoire
Epigénétique et destin cellulaire - EDC (CNRS/Université Paris Cité)
35 Rue Hélène BRION
75013 Paris