Quand le chaos génère de l’ordre entre les cellules
Au cours du développement embryonnaire, une cellule unique va donner naissance à des centaines de milliers de cellules spécialisées et organisées en tissus et organes fonctionnels. En s’intéressant aux cellules souches localisées dans la queue de l’embryon de caille, les scientifiques ont découvert que ces progéniteurs présentent des différences majeures d’expression de protéines clés impliquées dans leur choix de destin cellulaire. Leurs résultats expérimentaux et leurs modélisations mathématiques indiquent que ce « désordre » entre cellules voisines est nécessaire pour réguler les déplacements cellulaires et la formation ordonnée des tissus. Ces travaux sont publiés dans la revue eLife.
Lors du développement embryonnaire, la transformation d'une cellule unique en centaines de milliers de cellules formant des organes fonctionnels est un phénomène fascinant. Pour parvenir à cette organisation complexe, les cellules embryonnaires se divisent, migrent, se réorganisent en tissus et se spécialisent en une multitude de types cellulaires. Pendant que le corps de l'embryon prend forme, apparaissent des territoires précis dans lesquels des cellules souches spécialisées produisent les différents types cellulaires. Dans la queue des embryons de vertébrés, il existe une zone progénitrice (ZP) contenant des cellules souches capables de donner naissance à la fois aux cellules musculaires et osseuses (destin mésodermique), mais aussi au futur système nerveux (destin neural). Pendant que l'embryon s'allonge de la tête à la queue, ces cellules souches s'auto-renouvellent tout en produisant continuellement les cellules spécialisées qui vont constituer l’ébauche du corps de l’animal.
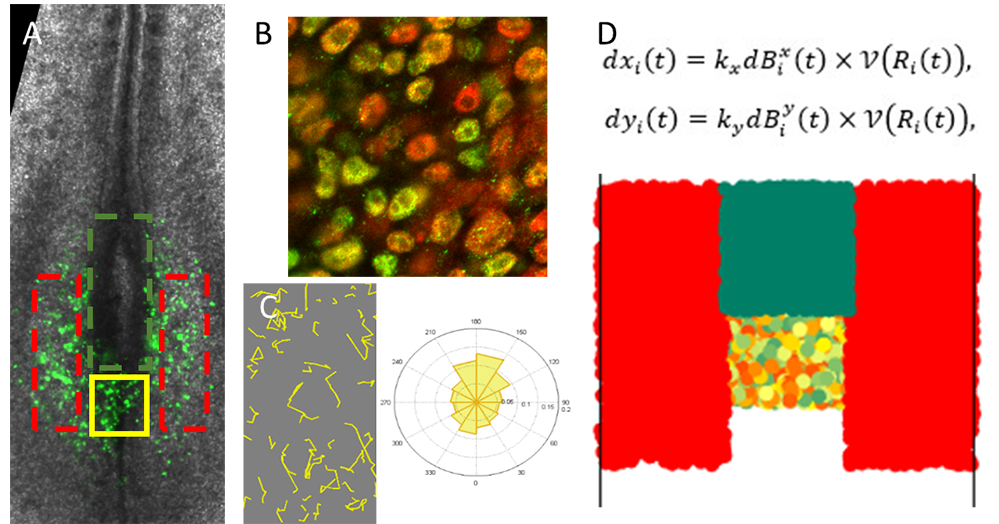
Dans ce travail, les chercheurs ont découvert que les progéniteurs de la ZP des oiseaux présentent des niveaux d’expression très différents (apparemment stochastiques) des protéines Sox2 et Brachyury (Bra), deux facteurs de transcription impliqués respectivement dans la spécification neurale et mésodermique. De plus, ils ont décrit que ces cellules migrent sans direction particulière, en changeant très souvent de voisines. Leurs expériences ont également révélé que Sox2 inhibe la migration des progéniteurs, favorisant ainsi leur intégration dans le tissu neural, alors que Bra favorise leur dispersion, les poussant latéralement à rejoindre le mésoderme. Quelle pourrait donc être l'importance de l'apparent chaos cellulaire régnant dans la ZP? Pour répondre à cette question, les scientifiques ont établi plusieurs modèles mathématiques et ont découvert que l'hétérogénéité spatiale favorise les réarrangements entre cellules et qu’elle est importante pour maintenir la forme de la ZP durant le développement.
Ce travail interdisciplinaire impliquant la biologie du développement, l’analyse d’image et les mathématiques suggère que l'hétérogénéité d'expression protéique entre cellules voisines représente une des propriétés d'auto-organisation des cellules embryonnaires. Les progéniteurs voisins expriment des niveaux variables de facteurs de transcription qui régulent leurs déplacements individuels. La chorégraphie cellulaire qui en résulte contribue à ségréger certains progéniteurs dans leurs tissus de destination tout en maintenant d’autres dans leur niche. Ces observations pourraient avoir des implications dans différents domaines et notamment l’étude des mécanismes du cancer, où les variations d’identité cellulaire et de propriétés migratoires sont souvent associés à un pronostic défavorable.
Pour en savoir plus :
Cell-to-cell heterogeneity in Sox2 and Bra expression guides progenitor motility and destiny.
Michèle Romanos, Guillaume Allio, Myriam Roussigné, Léa Combres, Nathalie Escalas, Cathy Soula, Francois Médevielle, Ben Steventon, Ariane Trescases, Bertrand Bénazéraf.
eLife 5 octobre 2021. DOI: 10.7554/eLife.66588
Contact
laboratoire
Centre de biologie intégrative (CBI) de Toulouse, Unité de biologie moléculaire, cellulaire et du développement (MCD) – (CNRS/Université Paul Sabatier)
118 route de Narbonne
31062 Toulouse Cedex 9
Institut de mathématiques de Toulouse (IMT), UMR 5219, Université de Toulouse, CNRS, 31062 Toulouse Cedex 9.