Quand l’ARN s’invite dans la réparation de l’ADN
Quand notre ADN se casse, nos cellules le réparent avec une haute précision. Mais une molécule inattendue, l’ARN, s’invite aussi dans ce processus. L’origine de cet ARN jusque-là encore très controversée vient d’être précisée dans une étude parue dans Nature Cell Biology. Cette découverte ouvre de nouvelles perspectives pouvant améliorer certaines chimiothérapies induisant des dommages à l’ADN.
ADN endommagé : pas de transcription pendant la réparation
Notre ADN est soumis à rude épreuve et subit de nombreux dommages tout au long de la vie. Parmi les plus graves figurent les cassures double-brin, où les deux fils de la double hélice d’ADN sont rompus. Mal réparées, elles peuvent entraîner des mutations ou des réarrangements du matériel génétique, et ainsi favoriser l’apparition de cancers. Lorsqu’une cassure touche un gène actif, c’est-à-dire un gène en train de produire de l’ARN, la cellule interrompt normalement cette production le temps que la réparation ait lieu. Cela semblait logique : pas de transcription pendant la réparation.
Un paradoxe intrigant : de l’ARN où il ne devrait pas y en avoir
Pourtant, un paradoxe étonnant est apparu. Au niveau même des cassures des structures hybrides ARN:ADN apparaissent. Ces structures sont composées d’une molécule d’ARN s’hybridant à un brin d’ADN. Comment expliquer la présence d’ARN à l’endroit même où leur production est censée être interrompue ? Ce mystère a intrigué plusieurs équipes de recherche à travers le monde, qui se sont alors attachées à élucider l’origine de ces ARN formés au niveau des cassures. Certaines ont alors proposé que la cassure elle-même pourrait déclencher une nouvelle production d’ARN. Pourtant, cette idée se heurtait à une contradiction majeure : comment une cassure de l’ADN pourrait-elle simultanément induire et stopper la production d’ARN ?
La clé du mystère : un ARN déjà présent avant la cassure
Dans un article publié dans la revue Nature Cell Biology, des scientifiques apportent une réponse. Grâce à des techniques de séquençage à haut débit, les scientifiques ont découvert une autre explication plus cohérente : ces hybrides ARN:ADN ne seraient pas formés à partir d’un nouvel ARN mais à partir de celui déjà présent dans la cellule avant que la cassure ne se produise. En d’autres termes, l’ARN resté sur place s’hybride à l’ADN cassé, formant ces structures inattendues. Et ce n’est pas sans conséquence. Les scientifiques ont montré que ces hybrides gênent fortement le bon déroulement de la réparation de l’ADN. Ils doivent donc être impérativement éliminés afin de préserver la stabilité du génome et d’assurer la survie cellulaire.
Cette étude apporte une nouvelle vision du rôle de l’ARN dans la réparation du génome. Elle ouvre de nouvelles perspectives quant à la manière dont ces mécanismes pourraient être ciblés à des fins thérapeutiques, notamment dans le développement de traitements anticancéreux.
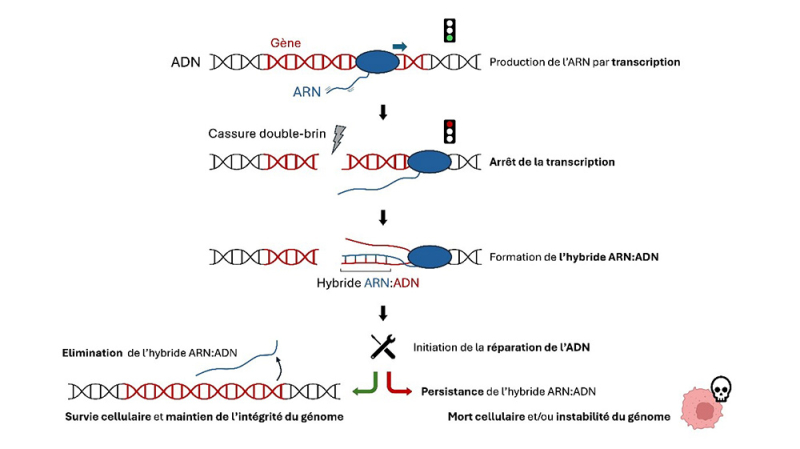
Figure : Formation et conséquences des hybrides ARN:ADN aux cassures double-brin. Lorsqu’une cassure survient au sein d’un gène actif, cela entraîne l’arrêt de la transcription, ce qui facilite la formation d’un hybride ARN:ADN. Cet hybride participant à l’initiation de la réparation doit cependant être éliminé pour permettre une réparation fidèle et le maintien de l’intégrité du génome et la survie cellulaire.
En savoir plus : Saur, F., Lesage, E., Pradel, L. et al. Transcriptional repression facilitates RNA:DNA hybrid accumulation at DNA double-strand breaks. Nat Cell Biol 27, 992–1005 (2025). https://doi.org/10.1038/s41556-025-01669-y
Contact
Laboratoire
Unité de biologie moléculaire, cellulaire et du développement - MCD (CNRS/Université de Toulouse)
Centre de biologie intégrative
165 Rue Marianne Grunberg-Manago,
31400 Toulouse
