Quand deux chaperons bactériens collaborent, l’union fait la force !
Le repliement des protéines est contrôlé dans chaque cellule vivante par une classe de protéines appelées chaperons, dont certains sont conservés des bactéries à l'homme. Un article publié dans la revue PNAS révèle la nécessité d’une coopération entre deux de ces chaperons, Hsp90 et DnaK in vivo chez les bactéries. Utilisant comme modèles deux espèces aux modes de vie très différents, cette étude suggère que la coopération entre chaperons bactériens a servi de base évolutive pour donner naissance à des systèmes de chaperons eucaryotes plus complexes.
Dans la cellule vivante, les protéines nouvellement synthétisées doivent se replier pour acquérir leurs fonctions. Ce repliement peut être spontané, ou assisté par une classe de protéines que l’on appelle « chaperons ». Hsp90 et Hsp70 (appelé aussi DnaK chez les bactéries) sont deux chaperons conservés des bactéries à l’homme. Un modèle mis en place il y a quelques années démontre la coopération des deux chaperons in vitro pour le repliement de substrats modèles.
Pour comprendre l’importance d’une telle coopération in vivo chez les bactéries, les scientifiques ont réalisé des mutations dans Hsp90 au niveau de sa région d’interaction avec DnaK. Chez Shewanella oneidensis, une bactérie aquatique, ils observent in vivo que la rupture de l’interaction entre Hsp90 et DnaK bloque la croissance lors d’un stress thermique. Ce défaut de croissance est lié à un substrat connu de Hsp90, appelé TilS. Ainsi, ils en concluent que le bon repliement de TilS nécessite la coopération entre Hsp90 et DnaK via une interaction directe entre les deux chaperons. Chez Escherichia coli, les mutations abolissant l’interaction entre Hsp90 et DnaK entrainent l’absence de production d’une toxine, la colibactine, connue pour être impliquée dans le développement de cancers chez l’homme. Ces résultats démontrent que la coopération entre Hsp90 et DnaK est nécessaire chez E. coli pour la production de colibactine dont la fabrication nécessite indirectement Hsp90, probablement par le repliement d’une ou plusieurs des protéines de cette voie de biosynthèse.
Ces travaux révèlent pour la première fois l’importance de la coopération entre les chaperons Hsp90 et DnaK chez les bactéries, tant dans les processus de stress que dans la production de toxine par les bactéries.
Chez les eucaryotes, la coopération entre Hsp90 et DnaK est connue également et fait intervenir d’autres partenaires. Le modèle de coopération entre Hsp90 et DnaK bactérien aurait donc évolué vers un système plus complexe, s’adaptant ainsi aux enjeux de la cellule eucaryote et à ses protéines.
Hsp90 est déjà connu pour être impliqué dans la pathogénicité de certaines bactéries. Etant donné l’importance de la coopération entre Hsp90 et DnaK dans la pathogénicité d’E. coli, cette étude pourrait constituer une ouverture au développement de nouvelles molécules pour limiter la virulence bactérienne alors que les bactéries multi-résistantes représentent un enjeu majeur de santé publique.
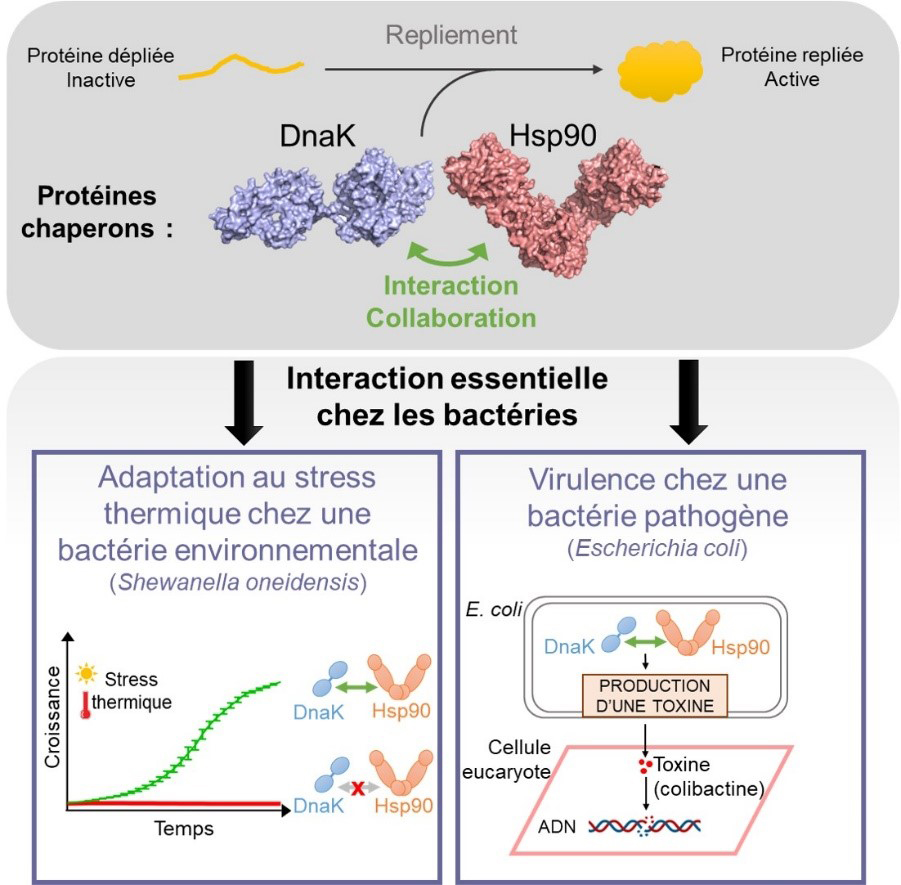
Figure : La coopération entre les chaperons Hsp90 et DnaK est importante pour l’adaptation au stress thermique de la bactérie S. oneidensis et pour la production d’une toxine chez E. coli.
Certaines protéines nécessitent pour être correctement repliées, l’intervention des chaperons DnaK et Hsp90 qui coopèrent via une interaction directe. En découplant les activités de Hsp90 et DnaK par des mutations ponctuelles sur Hsp90, les scientifiques ont démontré que cette coopération possède une réelle importance chez les bactéries in vivo. Une telle coopération est notamment nécessaire pour l’adaptation au stress thermique de la bactérie environnementale S. oneidensis, ainsi que pour la virulence du pathogène E. coli. Chez E. coli, l’activité couplée de DnaK et Hsp90 permet indirectement la biosynthèse de colibactine, une génotoxine responsable de cassures double-brin sur l’ADN de la cellule cible.
Pour en savoir plus :
Uncoupling the Hsp90 and DnaK chaperone activities revealed the in vivo relevance of their collaboration in bacteria.
Corteggiani M, Bossuet-Greif N, Nougayrède JP, Byrne D, Ilbert M, Dementin S, Giudici-Orticoni MT, Méjean V, Oswald E, Genest O.
Proc Natl Acad Sci U S A. 13 septembre 2022 doi: 10.1073/pnas.2201779119.
Contact
Laboratoire
Laboratoire de bioénergétique et ingénierie des protéines (CNRS/Aix Marseille Université)
31 Chemin Joseph Aiguier
13402 Marseille Cedex 20
