Pour un FLRT avec toi… : dimerisation du récepteur FLRT2 à la surface des cellules
Les protéines de la famille FLRT sont des récepteurs cellulaires jouant un rôle clé dans le développement neuronal. Jusqu'à présent, les recherches se focalisaient sur l’interaction de ces récepteurs entre deux cellules. En combinant simulations de dynamique moléculaire et microscopie de fluorescence, les scientifiques ont pu mettre en évidence un nouveau type d’interaction du récepteur FLRT2 présent à la surface d’une même cellule. Ces résultats sont publiés dans la revue Structure.
Les récepteurs FLRT fonctionnent comme des "reconnaisseurs de contexte" qui contrôlent la formation de différents complexes de signalisation afin de réguler le développement du cerveau. Jusqu'à présent, les recherches se focalisaient sur le domaine extracellulaire de ces récepteurs qui permettait la communication entre deux cellules.
Grâce à une collaboration internationale impliquant des chercheurs français et britanniques, les scientifiques ont mis en évidence un nouveau type d’interaction du récepteur FLRT2. En combinant des simulations de dynamique moléculaire aux expériences de microscopie de fluorescence de molécules uniques, il a été possible d’identifier cette interaction à la surface de la même cellule. Cette interaction implique à la fois le domaine transmembranaire de ce récepteur ainsi que le domaine extracellulaire.
Ce travail ajoute un niveau de complexité supplémentaire à tous les aspects de fonctionnement des récepteurs FLRT. Il constitue une nouvelle base de compréhension des mécanismes structurels qui déterminent la fonction de ces récepteurs dans le développement des tissus et suggère un nouveau mécanisme compétitif de liaison entre les récepteurs FLRT à la surface d’une même cellule et ceux pouvant interagir entre deux cellules.
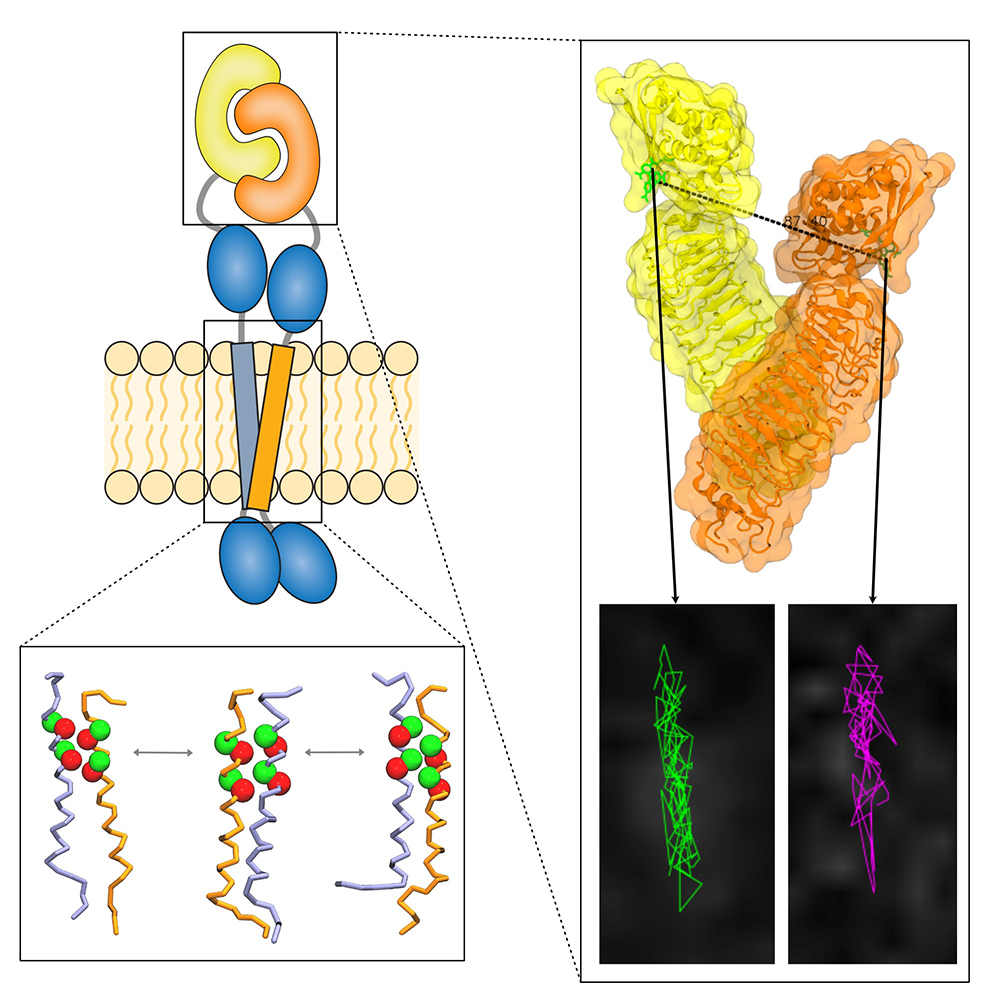
Figure : Modèle de l’interaction en cis du récepteur FLRT2 obtenu par combinaison de
modélisations de dynamique moléculaire (panneau du bas) identifiant l’interaction du domaine transmembranaire via deux motifs Small-xxx-Small et de microscopie de fluorescence à molécule unique (panneau de droite) permettant de suivre la co-diffusion de ces récepteurs).
Pour en savoir plus :
The guidance and adhesion protein FLRT2 dimerizes in cis via dual small-X3-small transmembrane motifs.
Jackson V, Hermann J, Tynan CJ, Rolfe DJ, Corey RA, Duncan AL, Noriega M, Chu A, Kalli AC, Jones EY, Sansom MSP, Martin-Fernandez ML, Seiradake E, Chavent M.
Structure. 3 juin 2022. doi: 10.1016/j.str.2022.05.014.
Contact
laboratoire
Institut de pharmacologie et de biologie structurale - IPBS (CNRS/Université Paul Sabatier )
205 Route de Narbonne
31400, Toulouse