Plasticité des réseaux de régulation génique chez les Pseudomonas
La survie des bactéries est contrôlée par des réseaux de régulation complexes permettant une adaptation à un environnement en constante évolution. Les chercheurs se sont intéressés à ces réseaux de régulation en analysant le rôle d’un régulateur transcriptionnel dans différentes espèces du genre Pseudomonas. Cette étude, publiée dans la revue Nucleic Acids Research, illustre l’intégration des gènes acquis par "transfert horizontal" dans les réseaux de régulation existants par émergence dans leurs promoteurs de sites de fixation reconnus par des régulateurs, leur assurant une expression adaptée à leurs conditions de vie.
Le genre bactérien Pseudomonas comprend plus d’une centaine d’espèces aux capacités d’adaptation exceptionnelles. Largement répandues dans l’environnement, elles sont présentes dans de nombreux écosystèmes différents, tels que le sol, les eaux, les plantes, les animaux et même les nuages. Au sein de cette famille se trouve aussi Pseudomonas aeruginosa, un pathogène opportuniste provoquant de nombreux problèmes de santé publique. P. aeruginosa est responsable de nombreuses infections aiguës et chroniques, et est aussi un des pathogènes les plus problématiques en termes de résistance aux antibiotiques.
L’Exolysine ExlA a récemment été identifiée comme un facteur de virulence majeur dans différentes espèces de Pseudomonas, provoquant la mort des cellules de l’hôte grâce à son activité de formation de pore dans les membranes eucaryotes. L’opéron exlBA codant pour la toxine ExlA et son transporteur membranaire ExlB a été acquis par ces espèces par transfert horizontal de gènes et inséré à différents endroits de leurs génomes. Au vu de la diversité d’environnements rencontrés par ces différentes bactéries, les chercheurs de l’équipe Bacterial Pathogenesis and Cellular Responses (PB&RC) se sont intéressés à la régulation de la synthèse de cette toxine dans plusieurs espèces, en collaboration avec une équipe de Harvard Medical School (Boston, USA).
Ils ont d’abord identifié dans différentes souches cliniques de P. aeruginosa un nouveau régulateur majeur de la synthèse d’ExlBA, un inhibiteur nommé ErfA. En utilisant des approches « omiques » comme le séquençage d'ARN (RNA-seq), ou le séquençage d'ADN purifié par affinité (DAP-seq), ils montrent que le régulon d’ErfA a une autre cible plus conservée, mais sans aucun rapport avec la toxicité. Pour comprendre cette co-régulation de deux fonctions différentes, les chercheurs ont déterminé les cibles d’ErfA par DAP-seq dans plusieurs espèces de Pseudomonas et ont montré que la régulation de exlBA, et donc de la virulence, est spécifique à Pseudomonas aeruginosa.
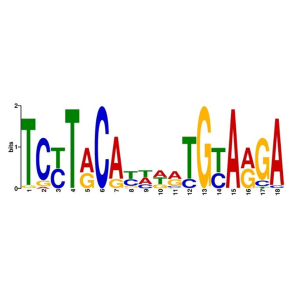
L’analyse des régions régulatrices d’exlBA dans 446 souches de Pseudomonas a montré une très grande diversité de séquences, alors que les séquences codantes de exlBA sont bien conservées. Notamment, les sites de fixation à l’ADN de ErfA, et de Vfr – un autre régulateur de l’opéron exlBA – sont apparus spécifiquement dans P. aeruginosa, alors que les autres espèces possèdent d’autres motifs prédits pour être reconnus par d’autres régulateurs.
Ces travaux illustrent un mécanisme d’adaptation des bactéries à différents environnements, pour lequel l’expression de gènes nouvellement acquis est reprogrammée par évolution des séquences régulatrices afin de mieux correspondre aux besoins spécifiques de l’environnement rencontré par la bactérie receveuse. En effet, après acquisition de nouveaux gènes, la pression évolutive deviendrait plus forte sur leurs séquences régulatrices, forçant la sélection de sites de fixations des régulateurs spécifiques permettant une expression adéquate par des voies de signalisation préexistantes. Ce mécanisme permettrait aux bactéries de se répandre et de prospérer dans de nombreux environnements différents.
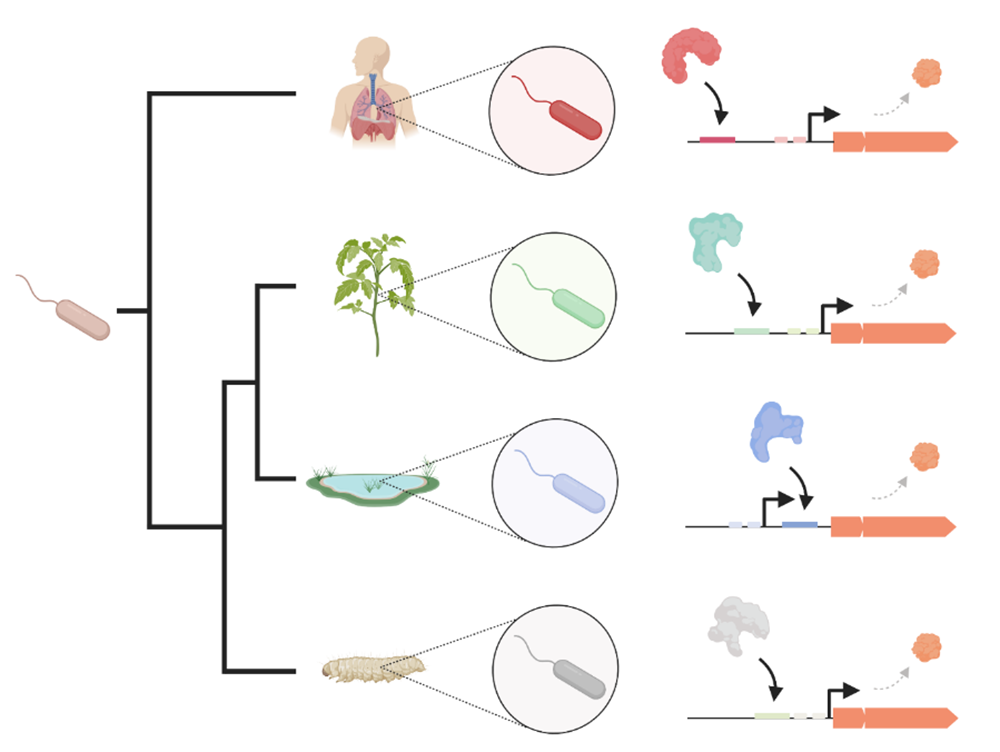
Figure : Illustration de la diversité de régulation des gènes dans des bactéries vivant dans des environnements différents (homme, plantes, eau, sol). Chaque espèce a développé des séquences régulatrices spécifiques pour les gènes exlBA (représentés en orange), permettant le recrutement de facteurs de transcription différents qui assurent une expression plus adaptée à des environnements spécifiques, tels que les tissus pulmonaires. Figure créée avec Biorender.com.
Pour en savoir plus :
Species-specific recruitment of transcription factors dictates toxin expression.
Trouillon J, Sentausa E, Ragno M, Robert-Genthon M, Lory S, Attrée I, Elsen S.
Nucleic Acids Res. 2020 Jan 11. pii: gkz1232. doi: 10.1093/nar/gkz1232. [Epub ahead of print]
Laboratoires :
Équipe Pathogénie Bactérienne et Réponses Cellulaires (CNRS)
Laboratoire Biologie du Cancer et de l’Infection (CEA/Inserm/Université Grenoble Alpes)
17 rue des martyrs,
38054 GRENOBLE cedex 09