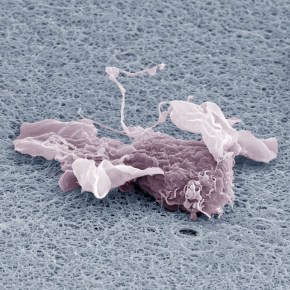
Petit mais costaud, ou comment le macrophage exerce des forces sur son environnement
Le cytosquelette d’actine est essentiel à la plupart des fonctions cellulaires, notamment via la génération et la transmission de forces mécaniques sur leur environnement. Pour comprendre comment des réseaux de filaments d’actine se coordonnent pour produire ces forces, il faut être capable de déterminer leur organisation à l’échelle nanométrique. En tirant partie des récents progrès de la cryo-tomographie électronique, les scientifiques montrent comment un réseau tridimensionnel de filaments d’actine agit comme un ressort pour permettre aux macrophages de sonder et déformer leur environnement. Ces résultats sont publiés dans la revue Nature Communications.
Le cytosquelette d'actine est essentiel à la physiologie cellulaire, du maintien de la forme au transport intracellulaire. Depuis le début des années 1990, on sait que l'ajout d'un monomère à l'extrémité d'un filament d'actine génère une force sur la membrane de l'ordre de quelques piconewtons. Ce calcul thermodynamique a été confirmé expérimentalement in vitro et constitue un des dogmes de la biologie cellulaire. Cependant, différentes méthodes d'analyse des forces cellulaires ont également révélé que les machineries cellulaires sont capables de générer des forces plusieurs milliers de fois plus élevées, jusqu'à plusieurs dizaines de nanonewtons. C'est le cas, par exemple, lors de l'endocytose chez la levure, de la migration cellulaire, ou lorsque des cellules immunitaires comme les macrophages sondent la rigidité de leur environnement. Comment les réseaux de filaments d'actine, qui génèrent individuellement quelques piconewtons, s'auto-organisent et se coordonnent pour produire des forces aussi importantes est une question centrale, qui reste sans réponse en raison de l'absence d'une méthode appropriée.
Pour répondre à cette question, les scientifiques ont observé des macrophages humains par cryo-tomographie électronique in situ. Cette technique, à ce jour la seule méthode capable de résoudre l'architecture 3D des réseaux cellulaires de filaments d'actine avec une résolution nanométrique, leur a permis d’analyser quantitativement l'organisation nanométrique des structures d’adhérence des macrophages. De manière surprenante, la somme des forces de polymérisation générées par les filaments à proximité de la membrane plasmique n'atteint pas un dixième de la force attendue. Ce résultat remet donc en question la seule théorie généralement acceptée de la génération de force par les filaments d'actine.
Dans le but d’expliquer ce phénomène, les scientifiques ont émis l’hypothèse que si certains filaments pouvaient supporter des forces aussi importantes, leur architecture devait en être affectée. C’est ainsi qu’en analysant la morphologie des filaments, ils ont constaté qu'ils étaient courts (environ 100 nm), courbés et qu'ils faisaient partie d'un maillage extrêmement dense. Ces filaments d'actine sont des polymères extrêmement rigides ; leur courbure observée révèle donc qu'ils sont soumis à une forte charge et stockent de l'énergie élastique. L'estimation de la force élastique exercée par un tel réseau chargé par un ressort donne 10 nN, et permet donc d’expliquer les forces mesurées expérimentalement.
En conclusion, en combinant microscopie de pointe et théorie physique, ce travail répond à une question cruciale en biologie cellulaire et révise le dogme de l'application de la force via la polymérisation de l'actine. Il montre que, pour comprendre les forces appliquées par les réseaux d'actine, il ne suffit pas de considérer les interactions locales entre l’actine et la membrane, mais qu'il faut prendre en compte l'ensemble du système, puisqu’un comportement élastique émerge de l’architecture des réseaux d'actine denses.
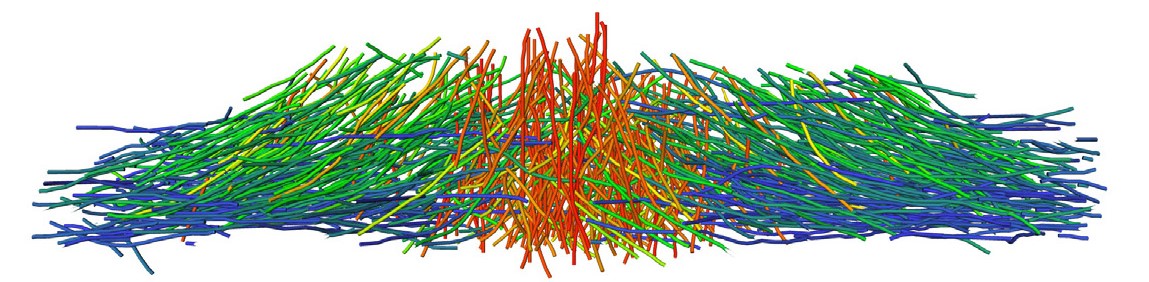
Figure : Vue en perspective de la segmentation 3D des filaments d'actine montrant leur orientation relative par rapport à la membrane basale, obtenu à partir de la segmentation d’un volume tomographique acquis dans un macrophage humain.
Pour en savoir plus:
Elasticity of podosome actin networks produces nanonewton protrusive forces
Jasnin M, Hervy J, Balor S, Bouissou A, Proag A, Voituriez R, Schneider J, Mangeat T, Maridonneau-Parini I, Baumeister W, Dmitrieff S, Poincloux R.
Nat Communications 4 juin 2022 | https://doi.org/10.1038/s41467-022-30652-6
Contact
Laboratoire
Institut de pharmacologie et biologie structurale (Université de Toulouse/CNRS/Université Toulouse III - Paul Sabatier)
205 route de Narbonne
31077 Toulouse