Participation de mécanismes épigénétiques au déficit mnésique associé à la maladie de Huntington
La maladie de Huntington est une maladie neurodégénérative génétique rare, affectant préférentiellement le striatum, une structure cérébrale clé. Cette étude parue dans la revue Progress in Neurobiology met en évidence une dérégulation épigénétique de gènes impliqués dans la plasticité du striatum, chez des souris modélisant la maladie et entraînées dans une tâche de mémoire impliquant le striatum. Ces nouveaux mécanismes du processus pathogénique pourraient être exploités à des fins thérapeutiques.
La maladie de Huntington est une maladie neurodégénérative héréditaire qui débute le plus souvent à l’âge adulte et entraîne la mort après 10 à 15 ans d’évolution. C’est une maladie qui affecte de façon primaire le striatum, une structure cérébrale impliquée dans le contrôle des mouvements volontaires, mais aussi dans certaines fonctions cognitives/psychiatriques, notamment la mémoire des habitudes (par exemple faire du vélo, conduire…), la flexibilité comportementale, la motivation…. Ces fonctions sont essentielles, car elles permettent à l’individu d’ajuster son comportement à un environnement qui par nature varie. Dans la maladie de Huntington, les symptômes cognitifs, qui précèdent généralement les atteintes motrices d’une dizaine d’années, ont un impact majeur sur la qualité de vie des patients. La prise en charge médicale de ces symptômes se limite aux thérapies cognitives et/ou comportementales. Le développement de traitements plus ciblés est entravé par la méconnaissance des mécanismes moléculaires et cellulaires qui sous-tendent les altérations cognitives spécifiques de la maladie de Huntington.
Chez les patients et souris modélisant la maladie, le dysfonctionnement et la dégénérescence progressives des neurones du striatum s’accompagnent d’altérations moléculaires et cellulaires majeures. Il a été montré précédemment qu’une dérégulation épigénétique précoce affecte ces neurones en perturbant l’expression de gènes impliqués dans le maintien de l’identité neuronale. Cette dérégulation est caractérisée notamment par des défauts d’acétylation des histones, un mécanisme permettant un état relâché de la chromatine, favorable à l’activation génique. Ainsi, des mécanismes épigénétiques pourraient contribuer au processus pathogénique mais comment précisément ?
Des travaux antérieurs chez l’animal, ont montré que les régulations épigénétiques jouent un rôle dans l’établissement de la mémoire à long terme, en gouvernant les mécanismes de plasticité cérébrale. Cette nouvelle étude effectuée à l’aide de souris modèles de la maladie de Huntington et de techniques « omics », permettant d’interroger l’état de la chromatine à l’échelle du génome, montre que le déficit de mémoire des habitudes, typique d’un dysfonctionnement du striatum, est associé à une diminution drastique des régulations épigénétiques et géniques impliquées dans la formation, la consolidation et le rappel de cette mémoire. Plus précisément, chez les animaux témoins, le processus mnésique s’accompagne d’un remodelage important de l’organisation spatiale de la chromatine, d’une augmentation du degré d’acétylation des histones au niveau de gènes responsables de la plasticité cérébrale, et de leur activation. Ces régulations, qui impliquent à la fois les neurones et les cellules gliales, sont fortement atténuées chez les souris modélisant la maladie de Huntington. L’étude permet enfin d’identifier des mécanismes et cibles nouvelles, notamment l’acétylation de la lysine 9 de l’histone H3 et la voie de signalisation TGF beta, qui pourraient être un point de départ au développement de stratégies thérapeutiques innovantes visant notamment à améliorer la cognition des patients.
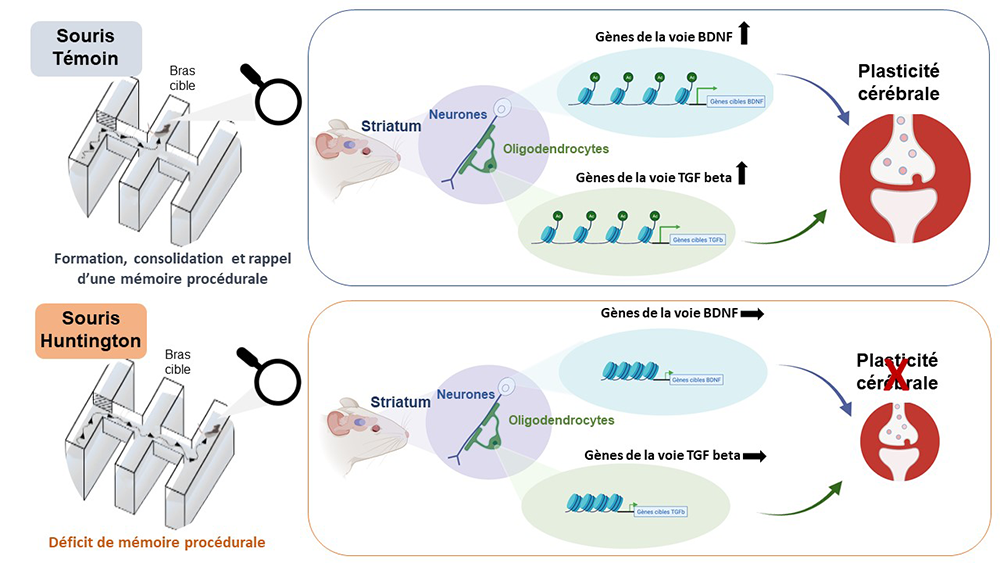
© Karine Merienne et Rafael Alcala Vida / Visuel créé avec Biorender
Pour en savoir plus
Altered activity-regulated H3K9 acetylation at TGF-beta signaling genes during egocentric memory in Huntington's disease.
Alcalá-Vida R, Lotz C, Brulé B, Seguin J, Decraene C, Awada A, Bombardier A, Cosquer B, Pereira de Vasconcelos A, Brouillet E, Cassel JC, Boutillier AL, Merienne K.Prog Neurobiol. 2022 Dec;219:102363. doi: 10.1016/j.pneurobio.2022.102363. Epub 2022 Sep 27.PMID: 36179935
Contact
Laboratoire
Laboratoire de neurosciences cognitives et adaptatives (LNCA) - (CNRS/ Université de Strasbourg)
12 rue Goethe
67000 Strasbourg
