Olfaction des insectes : spéléologie moléculaire dans un co-récepteur
L'olfaction n'est pas seulement un sens vital pour les insectes, elle présente également un intérêt pour la santé humaine, la santé animale et l'agriculture en tant que cible pour les répulsifs et les phéromones utilisés dans les pièges sélectifs. Dans un article publié dans Nature Communications, des scientifiques expliquent comment un ligand spécifique parvient à atteindre sa cavité de liaison profondément enfouie dans une sous-unité des récepteurs olfactifs d'insecte, le co-récepteur hautement conservé.
L'olfaction est un sens vital pour les insectes, qui leur permet de trouver de la nourriture, des partenaires et des sites de ponte, ou d'échapper à leurs prédateurs. Ce sens est également la cible de répulsifs, notamment contre les insectes piqueurs, ou de pièges à phéromones contre les nuisibles. Comprendre le fonctionnement du système olfactif chez les insectes est d'un grand intérêt pour la santé humaine et animale. On peut ainsi améliorer l'efficacité et la sécurité des répulsifs contre les insectes vecteurs de maladies. On peut aussi, en agriculture, optimiser l'efficacité des pièges à phéromones, afin de minimiser l'impact sur l'environnement et les espèces non ciblées.
Les insectes analysent en permanence leur environnement volatil grâce à leur organe olfactif. Les molécules volatiles sont détectées par des récepteurs olfactifs exprimés par des neurones sensitifs. La plus grande famille de récepteurs olfactifs d'insectes (OR) est composée de complexes constitués de deux sous-unités : une sous-unité ORx liant l'odorant et une sous-unité co-récepteur d’OR (Orco). Ces sous-unités ont évolué dans des directions opposées, les ORx divergeant tandis que les Orco sont restés très similaires. Chaque cellule nerveuse du système olfactif ne possède qu’un type d’OR présentant un spectre de reconnaissance spécifique. Au contraire la sous unité Orco a perdu sa sensibilité pour les ligands endogènes ou exogènes. L'assemblage de ces deux sous-unités forme un canal qui permet la diffusion d’ions (dans ce cas des ions positifs nommés cations) à travers la membrane cellulaire. Cet assemblage est la pierre angulaire de la perception qui transforme le signal chimique en signal électrique. Récemment, les structures d'un Orco et d'un OR "ancestral" ont été décrites à l’échelle atomique. Ces connaissances ont apporté des informations précieuses sur ces récepteurs, mais elles n'ont pas permis de comprendre comment les rares ligands d'Orco atteignent leur site de liaison. Ce dernier serait situé dans une cavité profonde et fermée à l'intérieur du récepteur selon les structures de l'OR "ancestral".
Un chemin caché au travers des structures des récepteurs olfactifs
Dans un article publié dans Nature Communications, des scientifiques ont mis en lumière les mécanismes moléculaires à l'origine de la migration de l'un des rares ligands artificiels connus d'Orco. Pour se fixer dans le récepteur, ce ligand emprunte un chemin caché au cœur de la structure d’Orco, voie dérobée qui n’a pu être observée qu'en tenant compte de la dynamique du récepteur, c’est-à-dire des vibrations et des réorganisations de la structure d’Orco, lors du passage du ligand.
Lors de la migration, la flexibilité du ligand lui permet de changer sa forme pour s’adapter à celle de la voie d’accès à la poche de liaison. Ce phénomène s'accompagne d'une désolvatation (processus qui permet au ligand de se séparer des molécules d’eau qui l’entourent) progressive qui favorise les contacts hydrophobes ligand-récepteur. Ces résultats confirment également la position du site de liaison du ligand dans la cavité enfouie. De plus, une analyse comparative avec différents Orco, OR et mutants a permis de délimiter la taille et le degré d'hydrophobicité de la cavité permettant la liaison du ligand dans l'Orco.
Faciliter le criblage virtuel et réel de nouvelles molécules à très large spectre pour perturber l'olfaction des insectes
Pour réaliser cette étude, les scientifiques ont combiné deux approches complémentaires basées sur la modélisation et la dynamique moléculaire, et la validation des simulations numériques par une étude structure-fonction à l'aide de mesures électrophysiologiques. Ces dernières ont été rendues possibles par l'utilisation de l'ovocyte de Xénope (un genre d’amphibien) comme système d'expression pour produire les nombreux mutants d'Orco testés dans cette étude.
La découverte du mécanisme spécifique d'entrée des ligands dans la sous-unité Orco et des spécificités spatiales et d'hydrophobicité de la cavité est une étape importante vers la compréhension de la haute sélectivité de ces récepteurs pour leurs ligands. Ces données faciliteront le criblage virtuel et réel de nouvelles molécules à très large spectre pour perturber l'olfaction des insectes. L'extrapolation de cette étude aux OR permettra de déterminer si ce mécanisme est également présent dans ces récepteurs, qui sont la cible de répulsifs et de phéromones.
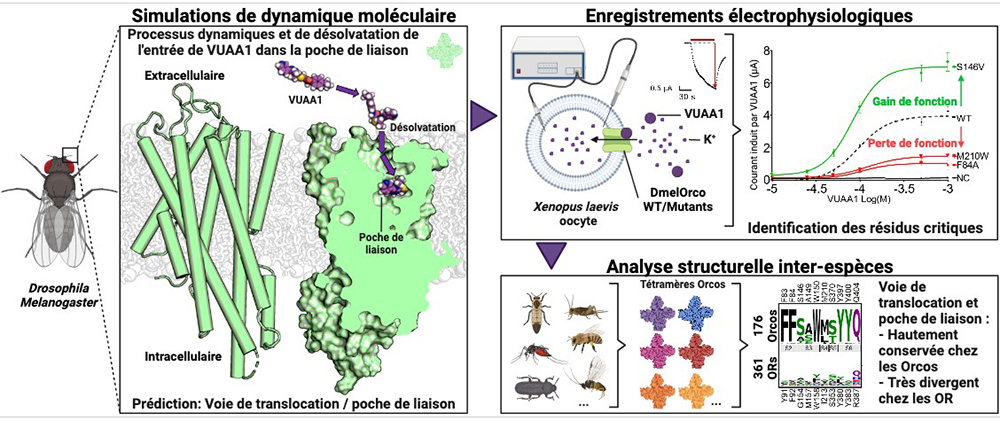
Figure : La liaison du ligand (VUAA1) dans le corécepteur du récepteur olfactif (vert) implique une désolvatation et des réarrangements conformationnels de la molécule pour atteindre son site de liaison enfoui dans le cœur de la protéine. Les résultats des simulations numériques sont étayés par une approche structure-fonction et des mesures électrophysiologiques. Le haut degré de conservation des corécepteurs (Orco) suggère que ce mécanisme est commun à de nombreuses autres espèces.
En savoir plus :
Pacalon, J., Audic, G., Magnat, J. et al. Elucidation of the structural basis for ligand binding and translocation in conserved insect odorant receptor co-receptors. Nat Commun 14, 8182 (2023). https://doi.org/10.1038/s41467-023-44058-5
Contact
Laboratoires
Institut de chimie de Nice - ICN (CNRS/Université Côte d'Azur)
28 Avenue Valrose,
06108 Nice Cedex 2
Institut de biologie structurale - IBS (CNRS/CEA/Université Grenoble Alpes)
71, avenue des Martyrs,
38054 Grenoble Cedex 9