Observer in vivo les cellules dendritiques plasmacytoïdes pour mieux comprendre leur activité antivirale
Les cellules dendritiques plasmacytoïdes (pDCs) s’activent rapidement contre les virus pour produire des interférons, qui se diffusent dans l’organisme pour renforcer la résistance à l’infection de chacune de nos cellules et pour orchestrer notre réponse immunitaire. Les scientifiques ont pu suivre in vivo les interactions entre cellules infectées et pDCs, pour la première fois, grâce à un nouveau modèle murin dont les pDCs sont rouges et deviennent jaunes lorsqu’elles produisent des interférons. Cette étude, publiée dans Nature Immunology, ouvre de nouvelles perspectives pour mieux comprendre les réponses immunitaires antivirales.
Les cellules dendritiques plasmacytoïdes (pDCs) présentent la capacité unique à rapidement détecter la survenue d’infections virales dans l’organisme, pour secréter de très grandes quantités d’interférons de type I et III (IFNs). Ces petites molécules solubles se diffusent dans le sang et induisent dans chaque cellule de notre corps la production de centaines de facteurs capables de bloquer la réplication virale. Outre cette fonction antivirale directe, les IFNs coordonnent l’activation de notre système immunitaire contre l’infection, en promouvant l’activation d’autres cellules immunitaires clefs dans la défense de l’organisme contre les virus, dont les cellules dendritiques conventionnelles (cDCs) qui sont indispensables à l’activation des lymphocytes T, les lymphocytes B qui produisent des anticorps capables de bloquer la réplication virale, ainsi que les cellules natural killer (NK) et les lymphocytes T cytotoxiques qui sont capables de reconnaître et tuer les cellules infectées. Etant donné que les pDCs sont une source majeure d’IFNs au cours de nombreuses infections virales, elles sont considérées comme jouant un rôle majeur dans l’immunité antivirale.
Les scientifiques ont récemment montré que la production d’IFNs est restreinte à une petite fraction des pDCs et qu’elle est très étroitement contrôlée dans l’espace et dans le temps. Cependant, de nombreuses questions restent ouvertes sur les fonctions des pDCs et leur régulation. Les pDCs interagissent-elles avec les cellules infectées par les virus, et si oui, quand, où et comment ? Quelles sont les conséquences fonctionnelles de ces interactions ? Les pDC produisant des IFNs communiquent-elles avec les pDC non-productrices, et si oui, où et comment ? Comment et où les pDC interagissent-elles avec les autres types de DCs pour orchestrer l’immunité anti-virale ?
Notre capacité à répondre à ces questions était jusqu’à présent très limitée suite à l’impossibilité d’identifier spécifiquement les pDCs in vivo.
Les scientifiques ont levé ce verrou grâce à l’utilisation d’une technologie d’ingénierie génétique innovante pour développer un nouveau modèle de souris dont les pDCs sont rouges et deviennent jaunes lorsqu’elles produisent des IFNs. Il devient ainsi possible de suivre in vivo les pDCs et leur activation pour la production d’IFNs, ainsi que de déterminer leurs interactions avec d’autres cellules. Ce modèle murin a permis de tirer parti de la microscopie confocale à fluorescence pour cartographier très précisément la distribution tissulaire des pDCs, observer la dynamique précoce de leur recrutement et de leur activation dans la rate des animaux infectés par un virus, et révéler l’existence d’interactions physiologiques entre pDCs et cellules infectées.
Une variante de cette stratégie génétique permettra la génération d’un second modèle de souris, constitutivement et spécifiquement dépourvu de pDCs, ce qui permettra pour la première fois de rigoureusement déterminer leur rôle physiologique. Ce travail ouvre ainsi de multiples perspectives de recherche, non seulement pour mieux déchiffrer la contribution des pDCs aux réponses immunitaires antivirales et sa régulation moléculaire, mais également pour approfondir notre compréhension du rôle controversé des pDCs dans l’immunité anti-tumorale et l’auto-immunité.
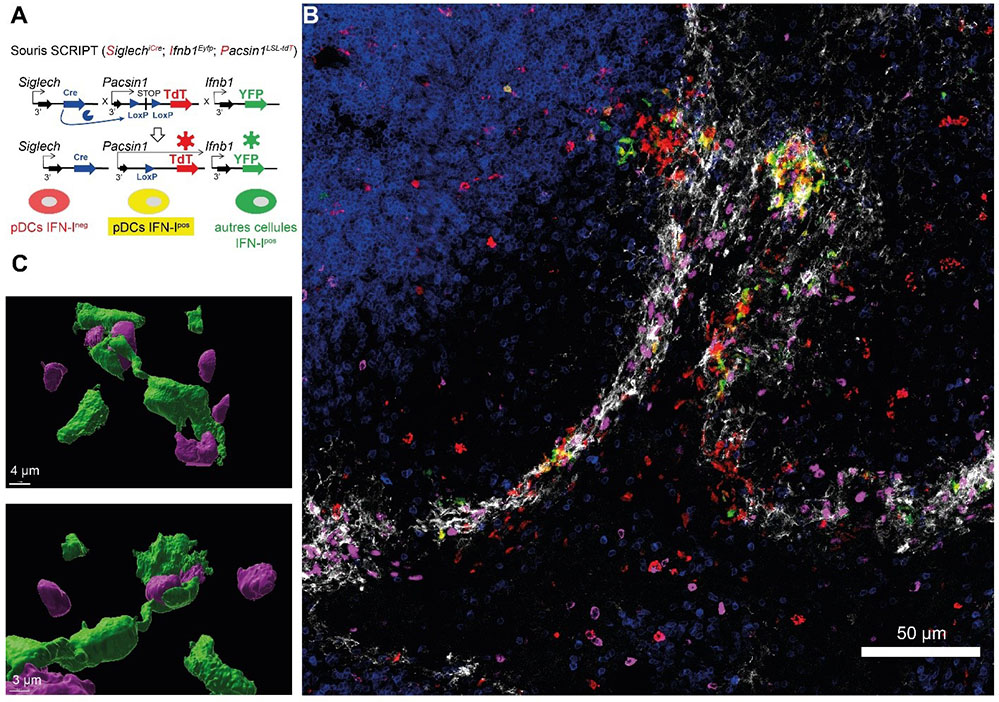
Figure : Observation des pDCs dans la rate de souris SCRIPT infectées par un virus.
A. Schéma de conception génétique des souris SCRIPT. B. Image en microscopie confocale à fluorescence d'une coupe de rate d'une souris SCRIPT infectée par le cytomégalovirus murin (MCMV). Les souris SCRIPT permettent la détection spécifique des pDC qui fluorescent en rouge et des cellules productrices d'interférons qui fluorescent en vert. Des marquages avec anticorps permettent de localiser les zones micro-anatomique de la rate et les cellules infectées : la zone où se trouvent les lymphocytes T, en bleu, et la zone marginale, en blanc, où le virus arrive par le sang et infecte des cellules, identifiées en rose. Précocement après l'infection, les pDC (rouge) se localisent majoritairement dans la zone marginale (blanc), où elles forment des agrégats (contour jaune) à proximité des cellules infectées (rose). Au sein de ces agrégats, on distingue des pDC produisant des IFN (vert/jaune). A ce temps d'infection, les pDC sont rares dans la zone T. C. Images reconstruites en 3 dimensions et montrant l'interaction entre une pDC productrice d'IFN-I (vert) et des cellules infectées (rose).
Pour en savoir plus :
Novel mouse models based on intersectional genetics to identify and characterize plasmacytoid dendritic cells.
M. Valente, N. Collinet, T.P. Vu Manh, D. Popoff, K. Rahmani, K. Naciri, G. Bessou, R. Rua, L. Gil, C. Mionnet, P. Milpied, E. Tomasello and M. Dalod.
Nature Immunology, 16 mars 2023. doi: 10.1038/s41590-023-01454-9.
Contact
Laboratoire
Centre d’Immunologie de Marseille-Luminy (CNRS, Inserm, Université Aix Marseille)
171 avenue de Luminy, 13288 Marseille cedex 09