NR2F2 : un acteur clé de la masculinisation du fœtus
Chez l’humain, de rares mutations du gène codant pour NR2F2 sont associées à des troubles du développement sexuel comme la cryptorchidie ou certaines malformations du pénis. Mais le rôle exact de cette protéine dans la masculinisation du fœtus reste mal connu. Dans un article publié dans eLife des scientifiques révèlent, chez la souris, le rôle déterminant de ce facteur dans le développement sexuel, offrant de nouvelles perspectives pour comprendre l’étiologie des troubles cliniques liés à des mutations de NR2F2.
Mise en place des testicules chez les mammifères
Le développement sexuel des mammifères est déterminé dès la vie fœtale. Chez l’embryon mâle (porteur de chromosomes XY), les gonades initialement indifférenciées se développent en testicules. Ceux-ci produisent des hormones stéroïdes mâles appelées androgènes (dont la testostérone), qui sont responsables de la différenciation des organes génitaux internes et externes masculins. Au cours du développement embryonnaire, cette production hormonale dépend surtout des cellules de Leydig fœtales (FLC). Ces cellules produisent à la fois les androgènes et l’hormone INSL3, indispensable à la descente des testicules de l’abdomen vers le scrotum.
Le rôle de la protéine NR2F2
Les mécanismes qui conduisent à la formation des FLC restent encore mal connus. On sait cependant qu’elles proviennent de cellules progénitrices situées dans le tissu interstitiel des testicules. Ces cellules se transforment en FLC grâce à des signaux paracrines (notamment DHH et PDGF) et à l’action coordonnée de plusieurs facteurs de transcription. Parmi eux, NR2F2 (ou COUP-TFII) est très présent dans ces progéniteurs, chez la souris comme chez l’humain. De rares mutations de NR2F2 sont associées à des anomalies du développement sexuel masculin, telles que la cryptorchidie (défauts de descente testiculaire) ou certaines malformations du pénis (hypospadias, micropénis), ce qui suggère que NR2F2 joue un rôle clé dans la formation des FLC.
Dans cette étude, publiée dans la revue eLife, les scientifiques ont exploré la fonction de NR2F2 dans le testicule embryonnaire de souris. Ils montrent que NR2F2 est exprimé dans les progéniteurs interstitiels mais que son expression décroît lorsque ces cellules se différencient en FLC. Ils ont ensuite inactivé le gène Nr2f2 dans les gonades embryonnaires de souris. Résultat : les embryons mâles présentaient des testicules anormaux, un déficit en FLC, une descente incomplète des testicules et des malformations du pénis. Ils ont aussi montré que l’absence de NR2F2 n’affecte ni la prolifération, ni la survie des progéniteurs, ni les signaux paracrines connus pour réguler la différenciation des FLC.
Ces résultats montrent que NR2F2 est indispensable à l’initiation de la différenciation et à la maturation des FLC, notamment via le contrôle de l’expression des enzymes de synthèse des hormones stéroïdes.
En conclusion, cette étude révèle un rôle fondamental et jusqu’ici sous-estimé de NR2F2 dans le développement des cellules fœtales de Leydig, productrices d’androgènes. Ce facteur de transcription s’impose comme un régulateur clé de la masculinisation embryonnaire, en orchestrant la différenciation et la fonction hormonale des FLC. Ces résultats offrent de nouvelles perspectives pour comprendre l’étiologie des troubles du développement sexuel (DSD) liés à des variants pathogènes de NR2F2.
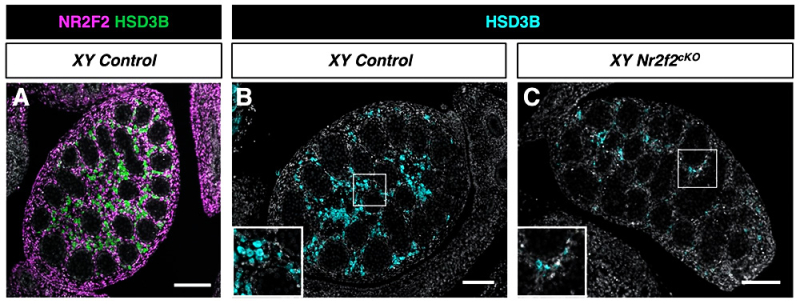
Figure : NR2F2 est requis pour la différenciation des FLC. (A) . La protéine NR2F2 (magenta) est détectée dans les noyaux des cellules progénitrices interstitielles du testicule de souris à 14.5 jours de développement. Les cellules fœtales de Leydig (FLC) marquées par l’expression de l’enzyme de synthèse des hormones stéroïdes HSD3B (vert) n’expriment pas NR2F2. (B, C) Les embryons XY mutants pour Nr2f2 (Nr2f2cKO) présentent des défauts du développement testiculaire avec une réduction du nombre de FLC marquées par HSD3B (cyan) à 14.5 jours de développement. Barre d’échelle = 100µm.
En savoir plus : Perea-Gomez A, Bellido Carreras N, Dhellemmes M, Tang F, Le Gallo C, Chaboissier MC. NR2F2 is required in the embryonic testis for fetal Leydig cell development. Elife. 2025 Jul 10;14:RP103783. doi: 10.7554/eLife.103783. PMID: 40637239; PMCID: PMC12245173.
Contact
Laboratoire
Institut de biologie Valrose - iBV (CNRS/Inserm/Université Côte d'Azur)
Equipe Détermination du sexe et fertilité
Parc Valrose,
Nice