Nanoparticules et protéine prion cellulaire : une rencontre à haut risque dans le cerveau
En combinant des approches in vitro et in vivo chez la souris, les scientifiques montrent que certaines nanoparticules présentes dans notre environnement pourraient jouer un rôle dans l’étiologie de la maladie d’Alzheimer. En interagissant avec la protéine prion cellulaire, les nanoparticules de dioxyde de titane et de noir de carbone induisent dans les neurones des signaux évocateurs de cette maladie. Les résultats sont publiés dans la revue Particle and Fibre Toxicology.
La maladie d’Alzheimer est la maladie neurodégénérative la plus répandue dans le monde dont l’incidence ne cesse d’augmenter depuis les années 1990 et qui touche aujourd’hui plus de 50 millions d’individus. Cette maladie est caractérisée par un déclin cognitif et mnésique progressif associé à une perte neuronale, notamment dans l’hippocampe, en réponse à l’accumulation et au dépôt dans le cerveau de protéines amyloïdes comme les peptides neurotoxiques Aβ.
Mis à part les formes familiales (héréditaires) de la maladie d’Alzheimer dans lesquelles des mutations de la protéine précurseur des peptides amyloïdes APP ou du complexe enzymatique g-sécrétase contribuent à l’augmentation de production des peptides Aβ, les facteurs responsables de l’accumulation des peptides Aβ dans les formes sporadiques (non-héréditaires) de la maladie d’Alzheimer, i.e., 99% des cas d’Alzheimer, demeurent totalement inconnus.
Les scientifiques montrent qu’une exposition à des nanoparticules manufacturées de dioxyde de titane (TiO2), très utilisées dans les crèmes solaires et les peintures, ou de noir de carbone (CB), que l’on retrouve dans l’industrie du pneumatique et de l’imprimerie, déclenche, dans des neurones murins en culture et dans le cerveau de souris, plusieurs événements typiques de la maladie d’Alzheimer dont l’accumulation des peptides Aβ. Le point de départ de l’effet pro-Alzheimer des nanoparticules de TiO2 et de CB est l’interaction de ces nanomatériaux avec la protéine prion cellulaire (PrPC) non pathologique à la surface des neurones (voir figure).
Il est maintenant établi que certaines nanoparticules, présentes dans notre environnement quotidien ou professionnel, peuvent pénétrer dans le cerveau et s’accumuler dans plusieurs régions cérébrales dont l’hippocampe. En montrant que l’interaction des nanoparticules de dioxyde de titane et de noir de carbone avec un même récepteur, la PrPC, déstabilise l’homéostasie neuronale et enclenche des signaux associés à la maladie d’Alzheimer, ces travaux révèlent comment certaines nanoparticules pourraient, en tant que polluants environnementaux, jouer un rôle causal dans l’émergence de formes sporadiques de la maladie.
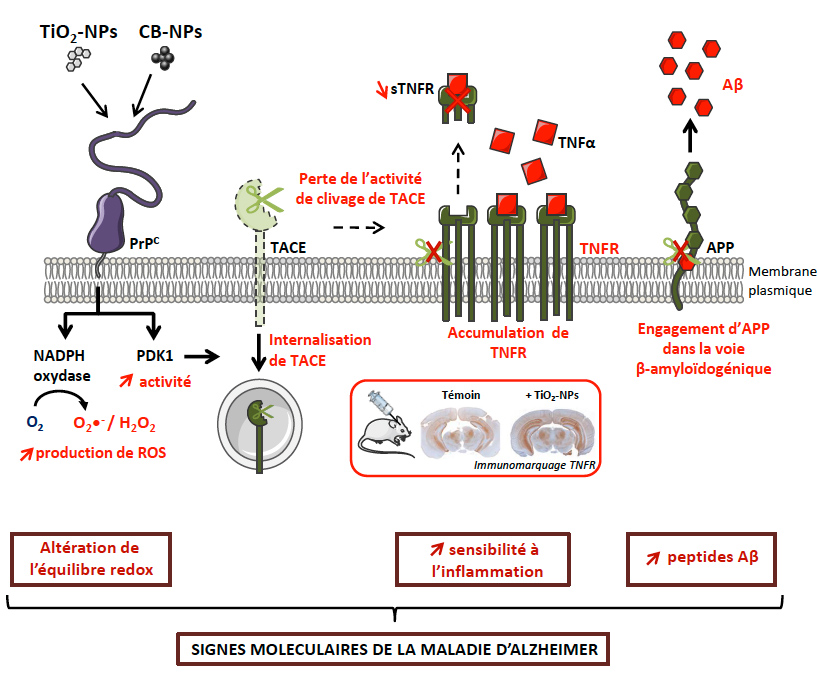
Figure : Les nanoparticules de dioxyde de titane (TiO2-NPs) ou de noir de carbone (CB-NPs) déclenchent dans les neurones des signaux caractéristiques de la maladie d’Alzheimer. Captées par la protéine prion cellulaire PrPC, les nanoparticules de TiO2 et de CB dérèglent la fonction neuroprotectrice de la PrPC menant à la suractivation de plusieurs acteurs de signalisation contrôlés par la PrPC : la NADPH oxydase, une enzyme productrice des espèces réactives de l’oxygène (ROS) et la kinase PDK1 (3-phosphoinositide-dependent kinase 1). La suractivation de la NADPH oxydase a pour conséquence de modifier l’équilibre redox des neurones. La suractivation de PDK1 entraine l’internalisation de l’α-sécrétase TACE (aussi connue sous le nom de ADAM17) annulant l’activité de clivage de TACE à la surface des neurones vis-à-vis de deux substrats majeurs : (i) les récepteurs de mort au TNFα (TNFR), ce qui vulnérabilise les neurones exposés aux nanoparticules aux effets toxiques du TNFα, et (ii) la protéine APP à l’origine de l’accumulation des peptides neurotoxiques Aβ par la voie β-amyloïdogénique. L’injection de TiO2-NPs dans le cerveau des souris provoque également un déficit d’activité TACE α-sécrétase comme l’atteste l’augmentation du signal TNFR dans différentes aires cérébrales, dont l’hippocampe. Cela établit la preuve de concept que des nanoparticules, une fois présentes dans le cerveau, exercent des effets adverses évocateurs de la maladie d’Alzheimer.
Pour en savoir plus :
Titanium dioxide and carbon black nanoparticles disrupt neuronal homeostasis via excessive activation of cellular prion protein signaling
Ribeiro LW, Pietri M, Ardila-Osorio H, Baudry A, Boudet-Devaud F, Bizingre C, Arellano-Anaya ZE, Haeberlé AM, Gadot N, Boland S, Devineau S, Bailly Y, Kellermann O, Bencsik A, Schneider B.Part Particle and Fibre Toxicology. 15 juillet 2022 doi: 10.1186/s12989-022-00490-x.
Contact
Laboratoire
Equipe "Cellules souches, signalisation et prions" (Inserm/Université Paris Cité)
45 rue des Saints-Pères
75006 Paris, France
