Morphogenèse et cicatrisation : la fin du mystère de la régulation des protéases BMP-1/tolloid-like
Les protéases BMP-1/Tolloid-like (BTPs) sont indispensables au développement embryonnaire, à la croissance et à la réparation des tissus. Elles sont aussi impliquées dans de nombreuses pathologies telles que les fibroses et le cancer. Malgré ces nombreux rôles nécessitant une régulation extrêmement précise, aucun inhibiteur endogène spécifique n’avait pu être mis en évidence chez les mammifères contrairement à d’autres espèces comme le poisson zèbre ou le poulet. Une étude publiée dans la revue Nature Communications révèle que l’inhibiteur endogène des BTPs humaines est PCPE-2.
La protéolyse est la seule modification post-traductionnelle qui est irréversible. Par conséquent, il est primordial que les activités des protéases soient finement régulées dans le temps et dans l’espace pour éviter la destruction des tissus et la libération aléatoire de molécules actives. Un des éléments clés de cette régulation est la présence de protéines inhibitrices endogènes et spécifiques. Les exemples les plus connus sont les serpines, les cystatines et les TIMPs (Tissue Inhibitors of MetalloProteinases).
Les BTPs jouent des rôles tout à fait essentiels dans la physiopathologie humaine. Ce sont les principales protéases impliquées dans l’assemblage de la matrice extracellulaire et notamment dans la biosynthèse des collagènes, les protéines les plus abondantes du corps humain. Elles permettent également l’activation de plusieurs facteurs de croissance (TGF-β, BMP, IGF) et libèrent des fragments anti-angiogéniques à partir d’hormones circulantes ou de protéines de la matrice extracellulaire. Enfin, elles régulent le métabolisme des lipides et la formation des nœuds de Ranvier dans le système nerveux périphérique. Ces fonctions font des BTPs des acteurs majeurs de la morphogenèse, du remodelage osseux et de la réparation tissulaire normale et pathologique. Ainsi, les mutations affectant les gènes codant pour ces protéases sont la plupart du temps létales ou causes de maladies graves telles que l’ostéogenèse imparfaite. Les BTPs ont plusieurs activateurs connus qui sont capables d’augmenter leur activité dans certains contextes mais, de façon assez unique, aucun inhibiteur endogène spécifique n’a été décrit jusqu’à ce jour.
En comparant une protéine activatrice, appelée PCPE-1 et bien caractérisée pour sa capacité à promouvoir l’assemblage des fibres de collagènes déclenché par les BTPs, avec une protéine très similaire (PCPE-2) décrite pour avoir la même activité mais beaucoup moins étudiée, les scientifiques se sont aperçus que le comportement des deux protéines différait significativement. Ainsi, les souris déficientes en PCPE-2 ne présentent pas de phénotype majeur au niveau des fibres de collagène contrairement aux souris déficientes en PCPE-1 et PCPE-2 est beaucoup plus faiblement exprimé par les principales cellules productrices du collagène (fibroblastes). De façon encore plus inattendue, les taux d’activation de la maturation protéolytique des collagènes dans des tests de clivage in vitro sont beaucoup plus faibles, voire nuls ou négatifs.
En revanche, les scientifiques ont observé que le clivage des autres substrats connus des BTPs (par exemple la thrombospondine-1, le bétaglycan, la chordine ou le récepteur aux LDL, représentatifs de différentes voies biologiques contrôlées par les BTPs), était très fortement affecté par la présence de PCPE-2 avec une réduction systématique et parfois totale de la quantité de fragments libérés. Ce résultat indique que PCPE-2 est principalement un inhibiteur des BTPs et une constante d’inhibition nanomolaire a pu être mesurée, en accord avec ce qui est généralement observé pour les inhibiteurs endogènes de protéases. Une étude mécanistique approfondie a ensuite révélé que la principale différence entre PCPE-1 et PCPE-2 est la capacité unique de ce dernier à se fixer sur les protéases BTPs pour bloquer leur activité. Cette interaction est spécifique car les protéases méprines qui appartiennent à la même famille que les BTPs ne sont pas inhibées par PCPE-2. PCPE-2 apparait ainsi comme le candidat idéal pour jouer le rôle d’inhibiteur endogène spécifique des BTPs.
Les perspectives de ce travail sont nombreuses et viseront notamment à identifier les situations physiopathologiques où ce mécanisme d’inhibition peut jouer un rôle déterminant. Au niveau structural, il sera également intéressant de révéler les déterminants moléculaires qui gouvernent le complexe protéase/inhibiteur et de s’en inspirer pour concevoir de nouvelles molécules thérapeutiques. Les applications potentielles de ces molécules incluent les fibroses, le cancer, les maladies métaboliques et les désordres musculaires.
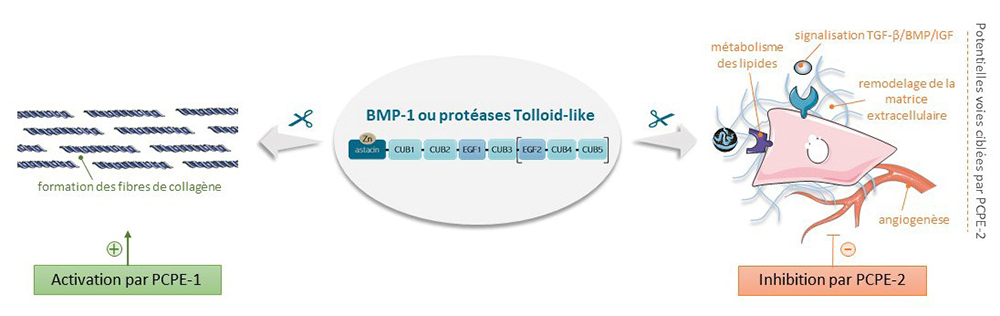
Figure : Régulation des BTPs par PCPE-1 et PCPE-2 et principales fonctions associées.
En savoir plus :
Vadon-Le Goff, S., Tessier, A., Napoli, M. et al. Identification of PCPE-2 as the endogenous specific inhibitor of human BMP-1/tolloid-like proteinases. Nat Commun 14, 8020 (2023). https://doi.org/10.1038/s41467-023-43401-0
Contact
Laboratoire
Laboratoire de biologie tissulaire et d'ingénierie thérapeutique - LBTI (CNRS/Université Claude Bernard)
7, Passage du Vercors
69367 Lyon Cedex 07