Mise en évidence des modifications moléculaires spécifiques à la gamétogénèse
Dans un article publié dans la revue EMBO Journal, des scientifiques ont utilisé une approche globale permettant de de comparer le devenir moléculaire de milliers de protéines afin d’identifier les modifications spécifiques à la méiose, une division cellulaire particulière qui permet la formation des gamètes.
Dans les divisions cellulaires, qu'il s'agisse de la mitose ou de la méiose, deux étapes clefs existent : la réplication de l’ADN au cours d’une phase appelée phase S et la séparation des chromosomes au cours de la phase M. La vitesse et la coordination de ces deux phases est contrôlée par des modifications moléculaires appelées phosphorylation. Ces modifications impliquent l’ajout d’un groupement phosphorylé par des enzymes appelées kinases, ou la suppression de ce même groupement par des enzymes appelées phosphatases. Ces actions enzymatiques altèrent l’activité des protéines concernées, jouant ainsi un rôle crucial dans le contrôle précis des événements cellulaires au cours de la division.
La levure, le parangon de nos connaissances sur les divisions cellulaires
La division méiotique (méiose) est spécifique aux cellules reproductrices, les gamètes, et a pour but de former des cellules différentes, contribuant ainsi à la diversité génétique des espèces. La méiose est une division dont l’originalité repose sur l’enchainement de deux phases-M de division, appelées méiose I (MI) et méiose II (MII), en absence de phase-S intermédiaire. Cela a pour conséquence de réduire de moitié son nombre de chromosomes et d’avoir comme produit des cellules haploïdes (cellules qui ne possèdent qu’un seul jeu de chromosomes).
Afin d’accomplir cet exploit cellulaire, le phosphoprotéome, qui réunis l’ensemble des protéines qui peuvent être modifiées par les kinases et les phosphatases, doit être modifié entre les deux phases-M. L’objectif est de parvenir in fine à une ségrégation chromosomique réussie et éviter toutes erreurs qui seraient délétères à la survie de la cellule, ou de l'embryon, dans les organismes plus évolués. Dans ce domaine de recherche, la levure a été intensivement utilisée pour étudier les divisions cellulaires. On lui doit de très nombreuses découvertes notamment sur des enzymes appelées kinases et phosphatases, dont les activités déterminent si une protéine donnée est phosphorylée ou déphosphorylée au cours du cycle cellulaire. Les kinases incorporent non seulement les phosphates dans les protéines mais doivent également les positionner au bon endroit et au bon moment du cycle afin d’assurer son bon déroulé, i.e. la réplication de l’ADN d’abord puis sa division. La plus connue de ces kinases est Cyclin-Cdk qui orchestre la progression du cycle cellulaire. Elle phosphoryle des protéines clés de la réplication de l’ADN ou de la division cellulaire et régule l’activité d’autres kinases et phosphatases contrôlant le cycle.
Comprendre la division méiotique en comparant sa première division à celle de la mitose
Dans cette étude, les scientifiques cherchaient à déterminer comment la sortie de la méiose I (qui est suivie par une seconde phase MII) diffère de la sortie de la mitose (qui est suivie par une phase S). En utilisant le modèle de la levure bourgeonnante, S. cerevisiae, les chercheurs ont analysé les changements du phosphoprotéome entre les deux phases-M méiotiques de façon résolutive dans le temps. Cette approche a permis de suivre les cinétiques de milliers d’évènements de phosphorylation sur des protéines du cycle cellulaire en sortie de méiose I dans un contexte normal et après une réduction artificielle de l'activité Cdk. Ils ont ensuite comparé les résultats obtenus avec des données antérieures générées sur la sortie de mitose afin de décrypter les particularités moléculaires propres à la division méiotique.
En mitose, la sortie de la division se caractérise par une très importante déphosphorylation des sites ciblés par Cdk afin de réinitialiser le cycle cellulaire et d’enchainer une phase-S. En sortie de méiose I en revanche, les scientifiques ont montré que les phosphorylations sur les sites Cdk sont très stables. La grande majorité des substrats phosphorylés par Cdk ne sont donc pas réinitialisés, suggérant que les sites Cdk doivent rester phosphorylés pour assurer la succession de deux phase-M en méiose. Néanmoins, de nombreuses protéines sont quand même déphosphorylées, mais sur des sites non reconnus par Cdk. Ces résultats suggèrent que Cdk n’est pas le seul acteur critique de la sortie de méiose I et que d’autres kinases et phosphatases sont essentielles pour contrôler la succession des deux divisions méiotiques.
Méiose : la kinase Cdk influence la succession des deux phases de division
Les scientifiques ont ensuite reconstitué en sortie de la méiose I un état similaire à celui d’une sortie de mitose, en réduisant fortement l’activité spécifique de Cdk. De manière surprenante, la chute complète de l'activité Cdk recrée les schémas classiques de phosphorylation observé en mitose pour les sites Cdk et les autres kinases qu’elle régule. Ce résultat démontre que le maintien d’un seuil d'activité Cdk en fin de méiose I est nécessaire pour éviter la déphosphorylation séquentielle des protéines et donc la réinitialisation complète du cycle cellulaire en sortie de méiose I. Ils démontrent ainsi que les cellules méiotiques ont la plasticité nécessaire pour reproduire en partie le scénario mitotique. Cette expérience a également permis de révéler des comportements de phosphorylation spécifiques à la division méiotique. En effet, certaines phosphorylations ne suivent pas un profil mitotique suite à la chute abrupte de l’activité de Cdk, révélant que des kinases spécifiques de la méiose et surtout non régulées par l’activité Cdk, contrôlent la succession des deux phases M.
Ces résultats vont permettre de cibler des études plus précises sur les protéines concernées afin d’élucider leurs fonctions spécifiques dans la méiose.
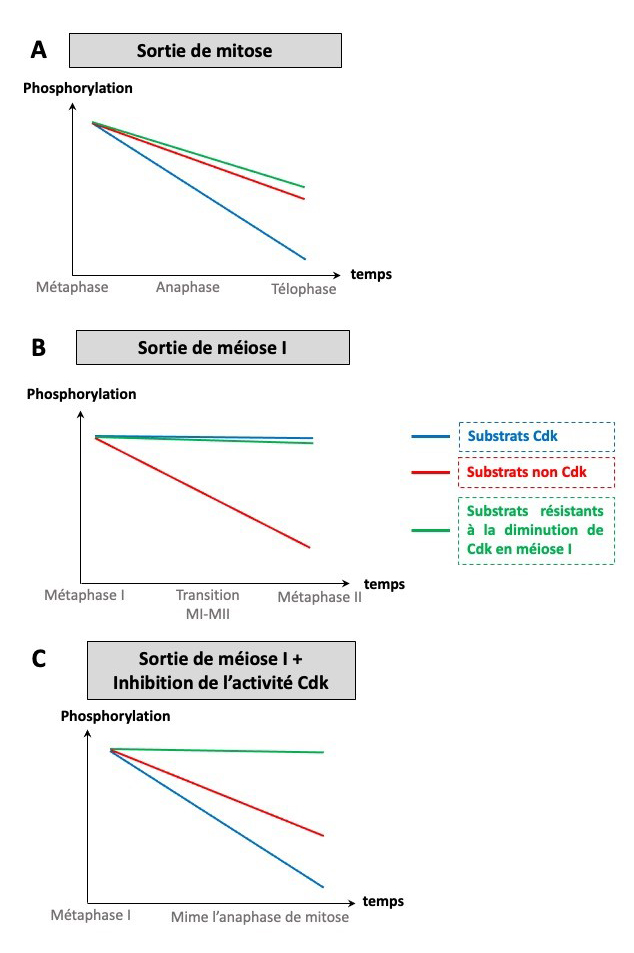
Figure : A. Lors de la sortie de mitose, les substrats Cdk sont déphosphorylés. De nombreux substrats non reconnus par Cdk le sont également. B. En sortie de méiose I, les substrats Cdk sont stables et les déphosphorylations ciblent majoritairement les substrats non reconnus par Cdk. C. En sortie de méiose I, lorsque l’activité Cdk est artificiellement diminuée, les substrats reconnus par Cdk sont déphosphorylés comme en mitose. En revanche, certains substrats résistent à cette diminution et restent stables.
En savoir plus :
Celebic D, Polat I, Legros V, Chevreux G, Wassmann K, Touati SA*. Qualitative rather than quantitative phosphoregulation shapes the end of meiosis I in budding yeast, EMBO J, 6 February 2024.https://doi.org/10.1038/s44318-024-00032-5
Contact
Laboratoire
Institut Jacques Monod (CNRS/Université Paris Cité)
15 rue Hélène Brion
75013 Paris