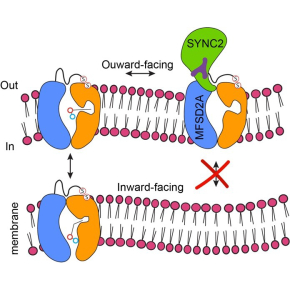
Mécanismes de fonctionnement du transporteur de l'acide gras essentiel oméga-3 humain
Le transporteur de la super-famille des facilitateurs majeurs MFSD2A a deux fonctions importantes dans le corps humain : il est la principale voie d'absorption des acides gras essentiels oméga-3 dans le cerveau, et le récepteur cellulaire de la protéine membranaire fusogène syncytine-2 qui médient la fusion cellulaire pendant le développement du placenta. Les scientifiques ont déterminé la première structure 3D du complexe humain MFSD2A-SYNC2 révélant des aspects-clés du fonctionnement et des mécanismes pharmacologiques de MFSD2A. Ces résultats sont publiés dans la revue Nature Structural & Molecular Biology.
Le système nerveux central (SNC) nécessite l'absorption d'acides gras oméga-3 essentiels sous forme de lysophospholipides pour un développement et une fonction cognitive normaux, ce qui est réalisé par le transporteur MFSD2A de la superfamille des facilitateurs majeurs. Ce transporteur est enrichi au niveau de la barrière hémato-encéphalique (BHE), une barrière cellulaire spécialisée et sélective qui contrôle l'échange de facteurs trophiques avec le sang et protège le cerveau de l'invasion pathogène. En particulier, l'absorption des lipides par MFSD2A est essentielle pour maintenir de faibles taux de transport de solutés à travers la BHE, via la répression du trafic de vésicules à travers l'endothélium, connue sous le nom de transcytose. Pour cette raison, la MFSD2A est apparue comme un point potentiel d'intervention pharmacologique pour faciliter l'administration de médicaments thérapeutiques dans le SNC. Cependant, le mécanisme de transport de la MFSD2A reste incomplètement compris, et aucun inhibiteur sélectif de la MFSD2A permettant de contrôler la perméabilité de la BHE n'a été signalé.
MFSD2A joue une deuxième fonction importante dans la physiologie humaine, en tant que récepteur de la protéine d'enveloppe dérivée des rétrovirus, la syncytine 2 (SYNC2), et les complexes MFSD2A-SYNC2 servent de médiateurs à la fusion cellule-cellule et à la formation de l'interface materno-fœtale dans le placenta. Il est intéressant de noter que SYNC2 partage le mécanisme de fusion membranaire avec les rétrovirus humains existants, comme le SARS-CoV-2 et le VIH. En fait, SYNC2 est codé par un ancien gène viral qui a été intégré dans le génome des simiens il y a plus de 40 millions d'années. Par conséquent, les humains utilisent une machinerie de fusion médiée par un récepteur provenant d'un ancien virus pour le développement du placenta, mais ses mécanismes de reconnaissance des récepteurs restent inconnus.
Les scientifiques présentent la première détermination de la structure d'une protéine rétrovirale endogène humaine (SYNC2) en complexe avec son récepteur cellulaire (MFSD2A), révélant un mécanisme de reconnaissance du récepteur qui a été préservé pendant des millions d'années. De plus, la structure de MFSD2A permet une cartographie directe des mutations qui provoquent la microencéphalie et les déficiences intellectuelles chez l'homme, et montre le transporteur dans un état intermédiaire important et insaisissable de son cycle de transport. Une comparaison de cet état conformationnel avec les structures rapportées des orthologues vertébrés de mfsd2a révèle un mécanisme moléculaire unique pour l'absorption des acides gras oméga-3 dans le cerveau. Ce mécanisme, appelé "rock-and-swing", permet l'occlusion et la translocation du substrat lipidique volumineux dans le noyau du transporteur, et représente probablement un mécanisme de transport lipidique conservé dans tous les règnes de la vie.
Une analyse structurelle plus poussée du complexe MFSD2A-SYNC2 suggère que la liaison à SYNC2 pourrait empêcher d'importants changements de conformation de MFSD2A. Sur la base de cette observation structurelle, les chercheurs ont mis au point un fragment soluble de SYNC2 qui inhibe complètement le transport des lipides par MFSD2A. Ce fragment constitue la première molécule de sa catégorie ayant le potentiel pharmacologique d'augmenter transitoirement la transcytose de la BHE et de faciliter l'administration de macromolécules thérapeutiques (par exemple, des anticorps) dans le SNC.
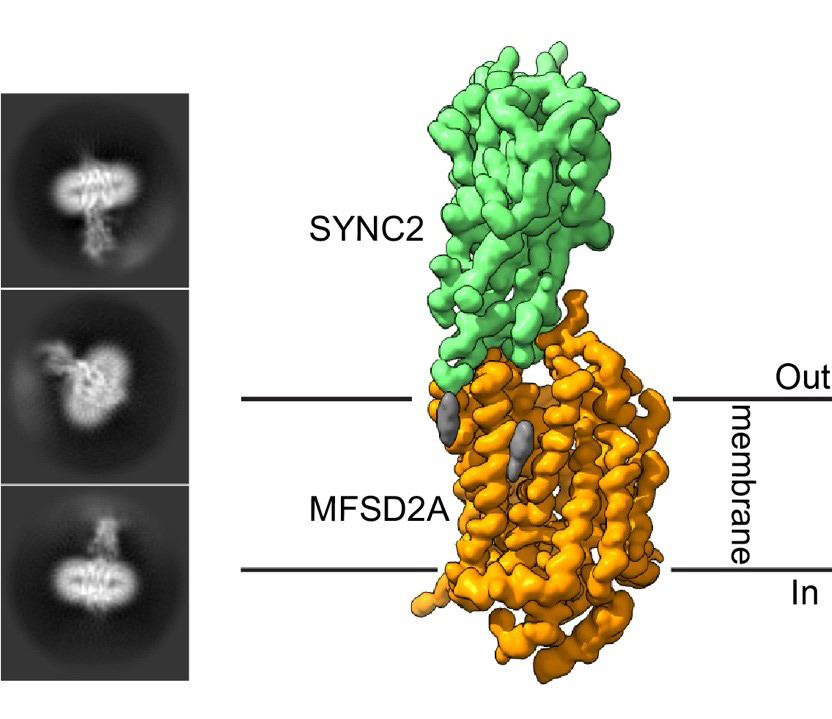
Figure : Classes 2D représentatives et carte cryo-EM 3D raffinée du complexe 1:1 MFSD2A:SYNC2SU. Les densités correspondant respectivement à MFSD2A (orange), SYNC2SU (vert) et aux molécules de lipides/détergents (gris) sont indiquées.
Pour en savoir plus :
Structural insights into lysophospholipid brain uptake mechanism and its inhibition by syncytin 2
Maria Martinez-Molledo, Emmanuel Nji & Nicolas Reyes
Nature Structural & Molecular Biology 16 juin 2022 https://doi.org/10.1038/s41594-022-00786-8
Contact
Laboratoire
Laboratoire de microbiologie fondamentale et pathogénicité (MFP) – (CNRS/Université de Bordeaux)
146, Rue Léo Saignat
33076 Bordeaux Cedex