Mécanisme d’action du cuivre, un puissant agent anti-microbien
Bien que le cuivre soit utilisé depuis l’antiquité pour ses propriétés anti-microbiennes, les bases moléculaires de sa toxicité sont encore mal connues. Ces travaux, publiés dans la revue mBio, démontrent que le cuivre est un puissant agent déstructurant entraînant l’agrégation des protéines. Pour contrer cet effet, les bactéries produisent des protéines chaperons, gardiennes de l’intégrité cellulaire. Ces résultats clarifient le mécanisme de toxicité du cuivre et son impact sur l’adaptation bactérienne.
Le cuivre (Cu) est un métal essentiel qui sert de cofacteur pour de nombreuses enzymes. Dans les systèmes biologiques, le cuivre est principalement retrouvé sous deux états rédox, Cu+ et Cu2+, lui conférant des propriétés attractives pour les cellules. Bien qu’indispensable, un excès devient rapidement toxique pour la cellule. Cette toxicité a été mise à profit à des fins thérapeutiques et industrielles, le cuivre étant actuellement largement utilisé pour ses puissantes propriétés antimicrobiennes et antivirales. Les mécanismes moléculaires liés à sa toxicité ont souvent été imputés à la production d’espèces réactives de l’oxygène (connu sous le nom de stress oxydant) et/ou à l’insertion non-spécifique du cuivre dans des métalloenzymes, processus connu sous le nom de mis-métallation.
En étudiant l’impact d’un excès de cuivre lors de la croissance de la bactérie Escherichia coli, les scientifiques ont pu observer l’accumulation d’agrégats protéiques. Par une approche interdisciplinaire, ce phénomène a pu être mieux décrypter. Dans un premier temps, le cuivre présent dans le milieu sous forme oxydé (Cu2+) pénètre dans la cellule bactérienne. Une fois dans le cytoplasme bactérien, le cuivre est rapidement réduit en Cu+. Malgré les processus de défense mis en œuvre, le cuivre va interagir avec des protéines intracellulaires en se liant à des résidus clés tels que les cystéines et les histidines. De telles interactions directes perturbent la structure d’un grand nombre de protéines engendrant la formation d’agrégats protéiques. Ce phénomène aboutit à l’inactivation de nombreuses protéines expliquant la forte toxicité du cuivre sur les cellules. Ce phénomène est amplifié en absence d’oxygène, dévoilant un processus indépendant du stress oxydant, pendant longtemps rendu responsable de l’effet toxique du cuivre.
Les protéines chaperons sont connues pour être des gardiennes de l’intégrité cellulaire. En utilisant des souches bactériennes dépourvues de chaperons, les chercheurs ont démontré leur rôle clé pour maintenir la fonction des protéines cellulaires lors d’un stress métallique. Ces résultats confirment que l’une des raisons de la toxicité du cuivre est bien due à une perturbation de l’homéostasie des protéines (« la protéostasie »).
L’effet néfaste du cuivre sur la protéostasie pourrait avoir des répercussions sur les recherches de nouveaux composés antibactériens dérivés du cuivre. D’autre part, le cuivre ayant été détecté dans les fibres amyloïdes, ces travaux pourraient permettre une meilleure compréhension du développement de certaines maladies neurodégénératives.
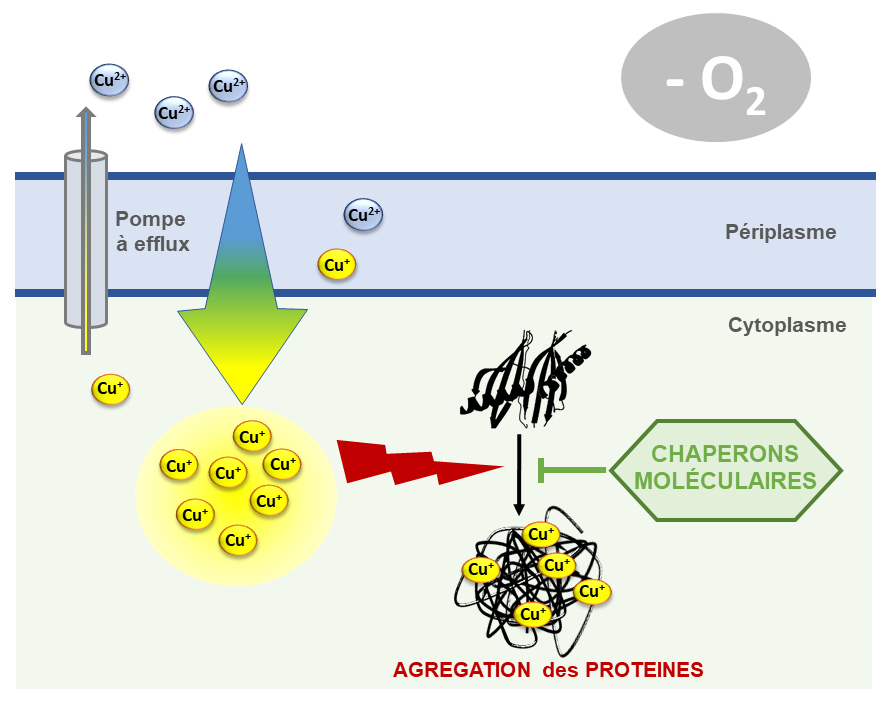
Figure : Mécanisme de toxicité du cuivre en anaérobie (-O2). Le cuivre présent dans le milieu sous forme oxydé (Cu2+) pénètre dans la cellule bactérienne. Une fois dans le cytoplasme bactérien, le cuivre est rapidement réduit en Cu+. Des pompes à efflux sont produites pour expulser ce composé toxique. Cependant, un excès de cuivre peut saturer ces systèmes, le cuivre s’accumule dans le cytoplasme et induit de la mis-métallation mais également un stress déstructurant aboutissant à l’agrégation de protéines via un processus indépendant du stress oxydant. Dans ces conditions de stress, les chaperons protègent les protéines intracellulaires de leur inactivation par le cuivre.
Pour en savoir plus :
Copper Induces protein aggregation, a toxic process compensated by molecular chaperones.
Zuily L., Lahrach N., Fassler R., Genest O., Faller P., Sénèque O., Denis Y., Castanié-Cornet MP., Genevaux P., Jakob U., Reichmann D., Giudici-Orticoni MT. and Ilbert M*.
Mbio. 15 mars 2022. DOI: https://doi.org/10.1128/mbio.03251-21
Contact
Laboratoire
Laboratoire de bioénergétique et ingénierie des protéines (CNRS/Aix-Marseille Université)
31 Chem. Joseph Aiguier
13400 Marseille