Maladie de Charcot: Une avancée dans la compréhension du mécanisme d’agrégation de TDP-43
Ces travaux, publiés dans la revue eLife, permettent de déchiffrer le mécanisme à travers lequel la liaison coopérative de la protéine TDP-43 à l’ARN messager prévient la formation d’agrégats toxiques, marqueurs de la maladie de Charcot, une maladie neurodégénérative majeure. Pour obtenir, ce résultat les scientifiques ont utilisé des approches structurales et cellulaires, notamment associées à une nouvelle technologie: la « MT bench ».
La maladie de Charcot ou Sclérose Latérale Amyotrophique (SLA) est une des maladies neurodégénératives majeures de l'adulte qui affecte progressivement et de manière irréversible les neurones moteurs du cerveau et de la moelle épinière. Au cours des 25 dernières années, la recherche sur les patients SLA a révélé des mutations dans plus de 20 gènes, parmi lesquels Sod1, FUS, C9orf72 et TDP-43 sont les plus affectés et ont été associés à des cas familiaux de la SLA. Des mutations dans TDP-43 ont été associées à la neurodégénérescence en favorisant la formation d’agrégats cytoplasmiques irréversibles. Par conséquent, TDP-43 fait actuellement l’objet de nombreuses recherches, notamment pour le développement de stratégies thérapeutiques visant à limiter l’agrégation de cette protéine.
Comprendre les mécanismes qui permettaient à TDP-43 de maintenir sa solubilité lorsqu’elle est liée à l’ARN messager dans le noyau des cellules dans des conditions normales, alors qu’elle précipite très rapidement in vitro pourrait ouvrir de potentielles pistes thérapeutiques.
Pour explorer comment TDP-43 peut maintenir sa solubilité en se liant à l’ARNm et éviter par ce biais son agrégation dans des conditions normales, les scientifiques ont utilisé une approche intégrative alliant une étude extensive de la structure du complexe TDP-43:ARN par des approches de RMN (imagerie par résonance magnétique) et de SAXS (diffusion des rayons X aux petits angles) et des données cellulaires en mesurant l’agrégation de TDP-43 dans le cytoplasme par la « MT bench », une nouvelle technologie récemment développée au laboratoire. Ils montrent que TDP-43 se lie de manière coopérative à l’ARNm lui permettant d’adopter une orientation qui réduit les interactions intermoléculaires entre certains domaines de la protéine (notamment son domaine prion-like, responsable de son agrégation cytoplasmique) et favorisant la mise en place d’une interface protéine-protéine stabilisée par plusieurs résidus d’acides aminés. Les mutations ponctuelles de ces résidus altèrent la liaison coopérative in vitro (RMN, ITC) et dans les cellules (MT bench).
Les scientifiques montrent enfin que la liaison coopérative de TDP-43 est essentielle pour son recrutement dans les granules des stress, qui sont des compartiments réversibles riches en ARNm, offrant ainsi un environnement propice au maintien de la solubilité de TDP-43. Avec les mutations altérant la coopérativité, ils observent la formation d’agrégats distincts des granules de stress.
L’impact de l'interaction de TDP-43 avec l’ARN sur son auto-association était déjà connu, mais jamais mesuré au niveau cellulaire ou bien établi sur le plan structural. Le fait de décrire précisément le mécanisme moléculaire menant à l’agrégation pourrait offrir des pistes pour tenter de s’opposer à ce processus pathologique
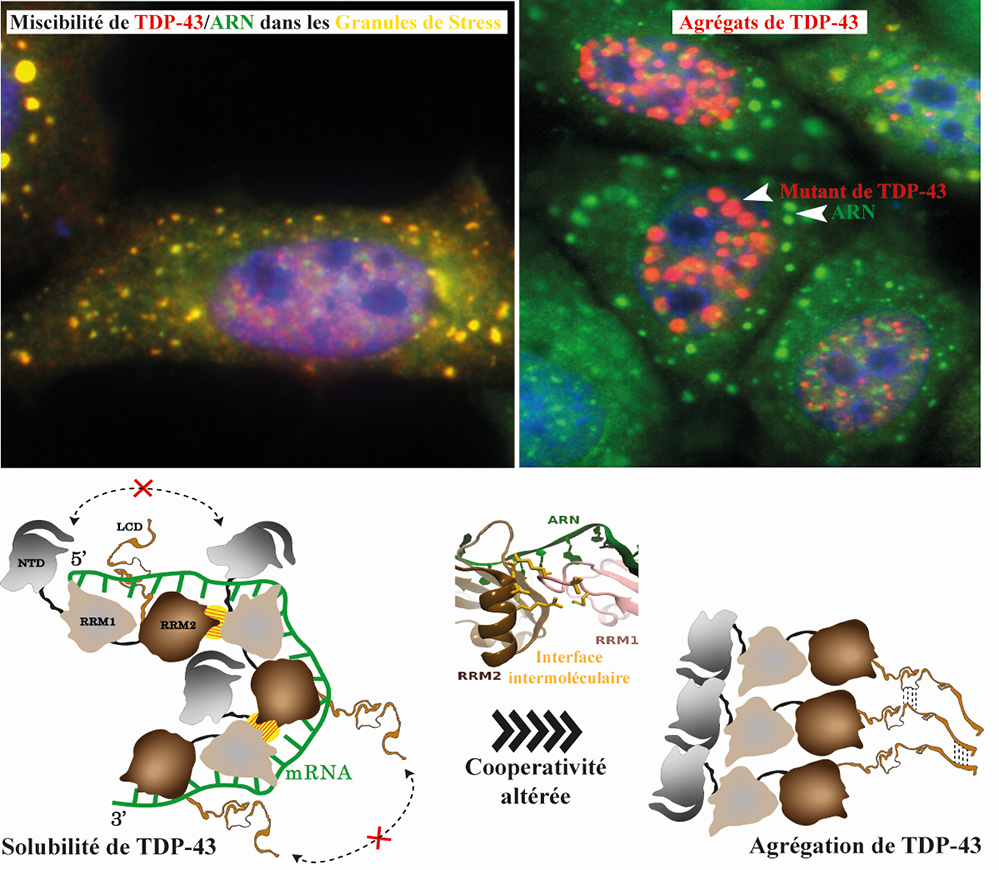
Figure :La liaison coopérative de TDP-43 à l'ARNm est essentielle pour son maintien dans un état soluble et fonctionnel.
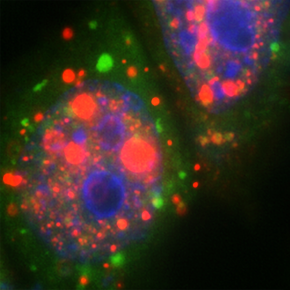
En haut, images de cellules HeLa soumises à un stress oxydatif, exprimant TDP-43 sauvage (rouge) (image à droite) qui se localise dans des granules de stress (jaunes) riches en ARNm (vert) alors qu’un mutant altérant la coopérativité de TDP-43 forme des agrégats (rouge) dépourvus d’ARNm (vert) (image à gauche).
En bas, un modèle d’assemblage de TDP-43 en présence d’ARNm. A l’état normal, en se fixant de manière coopérative sur l’ARN cible, des interactions intermoléculaires au sein de TDP-43 (hachures jaunes) impliquant le domaine RRM2 d’un premier monomère et le domaine RRM1 d’un deuxième monomère préviennent des auto-attractions des domaines N-terminal (NTD) et prion-like (LCD) entre des protéines de TDP-43 adjacentes. Une mutation affectant l’interface intermoléculaire, et donc la coopérativité de liaison à l’ARN, conduit à l’agrégation TDP-43.
Pour en savoir plus :
The cooperative binding of TDP-43 to GU-rich RNA repeats antagonizes TDP-43 aggregation.
Rengifo-Gonzalez JC, El Hage K, Clément MJ, Steiner E, Joshi V, Craveur P, Durand D, Pastré D, Bouhss A.
Elife. 2021 Sep 7. doi: 10.7554/eLife.67605.
Contact
laboratoire
Structure-Activité des biomolécules normales et pathologiques (SABNP) (Université Paris-Saclay/Inserm/Université d'Evry)
Boulevard François Mitterrand
91025 Evry-Courcouronnes
France.