Maladie de Charcot : comment une molécule clé bascule vers l’agrégation
Dans la maladie de Charcot ou sclérose latérale amyotrophique (SLA), la protéine TDP-43 forme des agrégats toxiques dans les neurones. Une nouvelle étude, publiée dans Nature Communications, décrypte comment, en conditions normales, la liaison de TDP-43 à l’ARN maintient cette protéine soluble dans le noyau, et comment la rupture de cet équilibre favorise son agrégation. Ces résultats ouvrent des pistes thérapeutiques inédites pour limiter la progression de la maladie.
Une protéine au cœur de la SLA
La sclérose latérale amyotrophique, aussi appelée maladie de Charcot, est une maladie neurodégénérative grave qui touche principalement les neurones moteurs. Dans près de 97 % des cas, elle est associée à l’accumulation anormale d’agrégats de TDP-43 dans le cytoplasme des neurones. Cette protéine, normalement localisée dans le noyau, joue un rôle essentiel dans la maturation et le transport des ARN messagers. Des mutations de TDP-43, qui favorisent son agrégation, ont par ailleurs été identifiées chez certains patients, faisant de cette protéine une cible centrale de la recherche thérapeutique.
Pourquoi TDP-43 s’agrège ?
Comparée à d’autres protéines de liaison à l’ARN, TDP-43 présente une propension exceptionnellement élevée à former des inclusions. Sa structure particulière, composée notamment d’un domaine N-terminal (NTD) structuré et de domaines centraux capables de lier l’ARN, a conduit les scientifiques à formuler l’hypothèse que des interactions entre domaines NTD pourraient initier une séparation de phase aberrante et conduire à l’agrégation. Jusqu’ici, il manquait cependant une description structurale de l’assemblage normal de TDP-43 lorsqu’elle est liée à ses cibles physiologiques : de longues séquences introniques riches en répétitions GU.
L’ARN comme garde-fou contre l’agrégation
En combinant des approches de résonance magnétique nucléaire, de diffusion des rayons X aux petits angles, ainsi que des analyses biochimiques et cellulaires, les scientifiques, dans un article publié dans la revue Nature Communications, ont montré que la liaison coopérative de TDP-43 le long des séquences GU empêche les interactions directes entre domaines NTD de protéines adjacentes. De manière inattendue, les domaines NTD de deux TDP-43 voisines restent physiquement éloignés lorsqu’elles sont alignées sur l’ARN. Cette organisation limite les interactions aberrantes et permet en parallèle de compacter de longs introns dans le noyau.
Du stress cellulaire à l’agrégation pathologique
Les expériences menées dans les cellules montrent que l’équilibre est fragile. En situation de stress oxydatif, lorsque la fixation coopérative de TDP-43 à l’ARN est perturbée, les interactions NTD/NTD deviennent dominantes et favorisent l’agrégation. Ce processus est renforcé par des modifications post-traductionnelles, comme l’acétylation de certaines lysines dans les domaines de liaison à l’ARN, qui renforcent l’auto-association de TDP-43 en l’absence d’ARN. À l’inverse, l’expression artificielle d’introns riches en répétitions GU réduit significativement la formation d’agrégats, même en conditions de stress.
De nouvelles pistes thérapeutiques
Ce travail met en lumière un mécanisme fondamental qui maintient TDP-43 soluble dans le noyau des neurones et identifie le domaine N-terminal comme un acteur clé de l’agrégation pathologique. Deux stratégies thérapeutiques se dessinent : renforcer l’assemblage coopératif de TDP-43 à l’aide d’ARN riches en GU, ou cibler les modifications chimiques favorisant l’auto-association coopérative sur l’ARN de la protéine. Ces avancées concernent non seulement la maladie de Charcot, mais aussi d’autres maladies neurodégénératives, comme la démence fronto-temporale, dans laquelle TDP-43 est impliquée.
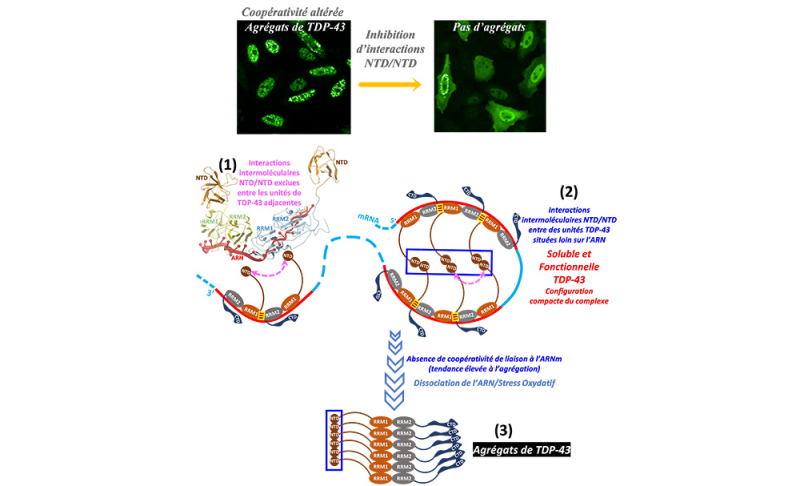
Figure : Représentation du modèle d’assemblage supramoléculaire de TDP-43. La coopérativité de liaison à l’ARN prévient les interactions intermoléculaires NTD/NTD entre les unités de TDP-43 adjacentes et favorisant ainsi la solubilité de TDP-43 (1). En revanche, les interactions intermoléculaires NTD/NTD entre des unités TDP-43 situées loin sur l’ARN sont facilitées et ces interactions assurent la compaction des long introns (2). L’absence de coopérativité de liaison à l’ARNm favorise les interactions intermoléculaires NTD/NTD entre des unités de TDP-43 adjacentes et une tendance élevée à l’agrégation. Ainsi, par dissociation de l’ARN ou suite à un stress oxydant, les interactions intermoléculaires NTD/NTD favorisent l’agrégation impliquant les domaines RRM responsables de la liaison de l’ARNm et formation accrue d’agrégats de TDP-43 (3).
En savoir plus : Feng, Y., Joshi, V., Pankivskyi, S. et al. From TDP-43/RNA complex formation to disease-linked TDP-43 aggregation through a structural and cellular approach. Nat Commun (2026). https://doi.org/10.1038/s41467-026-68346-y
Contact
Laboratoire
Structure-Activité des Biomolécules Normales et Pathologiques - SABNP (Genopole/Inserm/Université Evry Paris-Saclay/Université Paris-Saclay)
91025 Evry-Courcouronnes, France

