Lymphomes B agressifs : déchiffrer les résistances pour de nouvelles stratégies thérapeutiques
Les thérapies ciblées offrent de nouveaux espoirs contre les lymphomes B agressifs mais les capacités de ces cancers à développer, dans le système lymphatique, des mécanismes pour contrer les traitements entrainent des rechutes fréquentes. Dans cette étude publiée dans la revue Blood, en combinant l’étude des gènes (génomique) et l’analyse de leurs niveaux d’expression (transcriptomique) à l’échelle de la cellule unique, les scientifiques décryptent les mécanismes moléculaires de résistance. Ils identifient ainsi les vulnérabilités spécifiques des cellules cancéreuses pour développer de nouvelles stratégies thérapeutiques.
Depuis le début des années 2000, de plus en plus d’alternatives thérapeutiques à la chimiothérapie s’offrent aux patients atteints de cancers solides et hématologiques. Parmi ces alternatives, les thérapies ciblées montrent des activités très prometteuses et arrivent aujourd’hui en première ligne de traitement. Au cours de la dernière décennie, les efforts déployés pour caractériser les profils moléculaires des cellules de lymphome B, ainsi que les multiples interactions qui se produisent au sein de leurs écosystèmes malins, ont permis d'identifier les vulnérabilités (talon d’Achille) de la tumeur. Parmi celles-ci, l'expression élevée de l’antigène CD20, un déséquilibre de la famille BCL2 (résistance à l’apoptose) et une signalisation BCR (récepteur B à l’antigène) constitutive sont apparus comme des voies d’intérêt pour la mise au point de combinaison de thérapies ciblées. 1
Des clones résistants provoquant la rechute des patients
Néanmoins, l'hétérogénéité et la plasticité des cellules tumorales limitent leur efficacité à long terme, des clones résistants provoquant la rechute des patients atteints de lymphomes B agressifs.
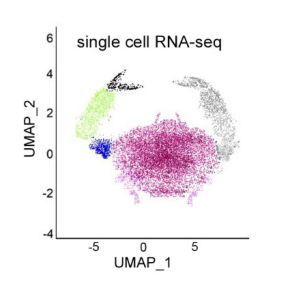
Dans ce travail publié dans la revue Blood, les scientifiques ont étudié ces mécanismes de résistance à travers l’étude génomique et transcriptomique à la résolution de la cellule unique sur des prélèvements de patients traités par une combinaison de thérapies ciblées. Ils ont démontré l'émergence de sous-clones présentant un avantage sélectif, établi une nouvelle signature transcriptomique de résistance et décrypté les mécanismes moléculaires qui sous-tendent l'échappement tumoral.
Dans le cas présent, ils ont montré que les cellules résistantes étaient caractérisées par une surexpression de gènes cibles d’une voie de signalisation devenue anormalement indépendante de celle du BCR, la voie NFkB. Cette surexpression était en particulier liée à des mutations d’une protéine dénommée CARD11. Parmi les cibles de cette dernière, ils ont identifié une autre molécule, BCL2A1, comme central dans la résistance aux inhibiteurs de BCL2. D’autre part, les résultats de cette étude positionnent BCL2A1 comme un relais sélectif entre la voie BCR/BTK/CARD11 et l'apoptose mitochondriale.
Des résultats qui pourraient être appliqués à un large spectre d'hémopathies malignes
Sur la base des mécanismes découverts, des études fonctionnelles ont été réalisées, dans des modèles in vitro (cellules humaines) et in vivo (xénogreffes (PDX) sur modèle aviaire), afin d'identifier les vulnérabilités thérapeutiques qui pourraient être exploitées pour surmonter la résistance tumorale. Ainsi, les scientifiques ont démontré que l'inhibition d’une protéine partenaire de CARD11, essentielle à la transduction du signal, la protéase MALT1, conduisait à la réduction des gènes impliqués dans la résistance, notamment BCL2A1. Sur la base de ces résultats, une nouvelle stratégie de combinaison ciblant MALT1 et BCL2, a été proposée. Elle se traduit par une mort cellulaire synergique, indépendamment du statut mutationnel de CARD11. L’efficacité de cette stratégie a notamment été confirmée dans des modèles vivo alternatifs aux rongeurs, de type in ovo (Test CAM, Chick Chorioallantoic Membrane).
Dans l'ensemble, cette étude a identifié des mécanismes de résistance aux combinaisons de thérapies ciblées chez les patients atteints de lymphome B agressif et propose une nouvelle stratégie pour surmonter cette résistance. Étant donné la fréquence des anomalies des voies BCR/CARD11 et l’intérêt croissant pour les thérapies les ciblant, nos résultats pourraient être appliqués à un large spectre d'hémopathies malignes.
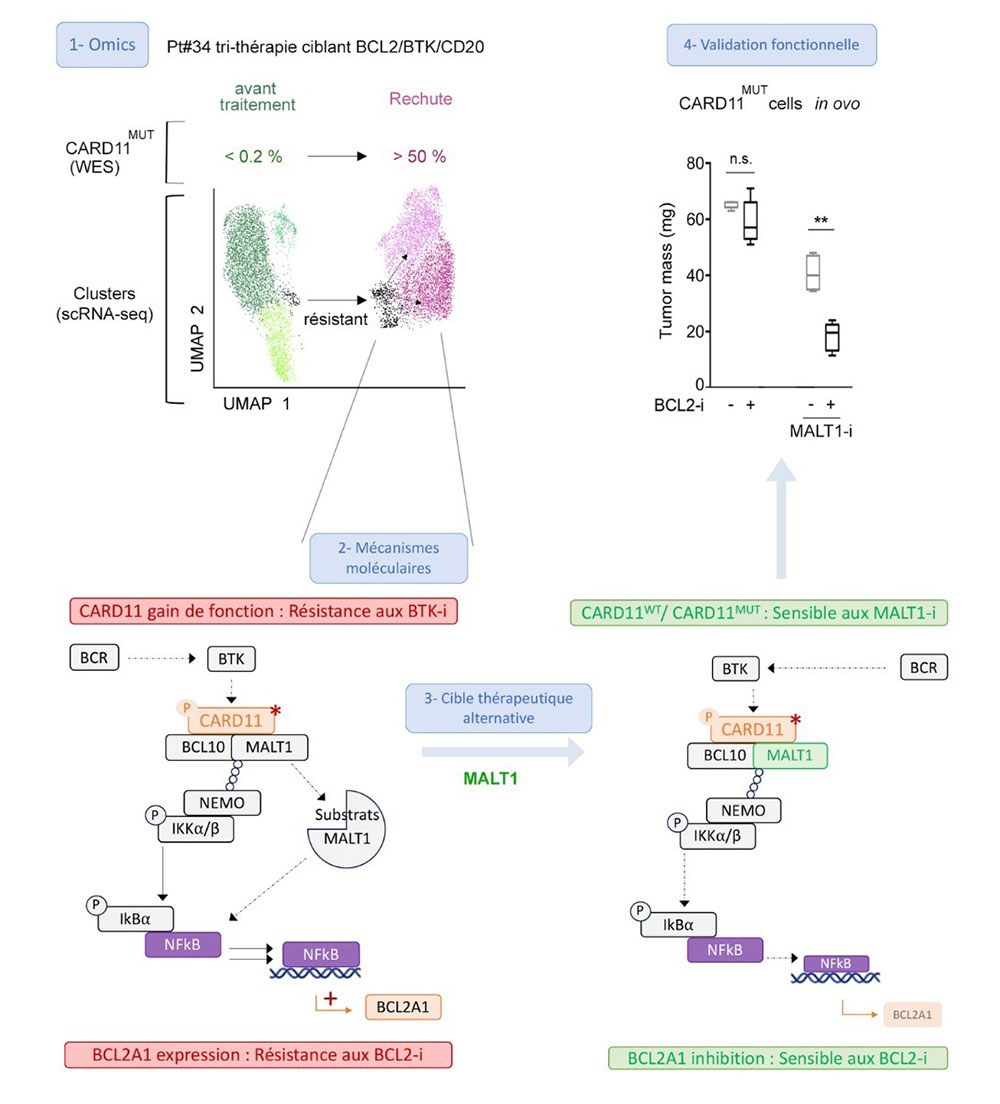
Figure : 1. La caractérisation par des techniques de séquençages haut-débit d’ADN et d’ARN (Omics) de prélèvements de patients traités par des thérapies ciblées a mis en évidence l’implication des mutations CARD11 ainsi que le profil transcriptomique de sous-populations résistantes in vivo. 2. Des études moléculaires in vitro ont ensuite montré que ce gain de fonction de CARD11 entraine l’indépendance des cellules tumorales aux voies BCR/BTK ainsi qu’une induction de cibles protumorales tel que BCL2A1. 3. La recherche de cibles thérapeutiques alternatives a mené à l’étude de l’inhibition de la protéase MALT1, partenaire essentiel de CARD11 pour la transduction du signal et l’induction de BCL2A1. 4. L’hypothèse de l’efficacité du ciblage de MALT1, seul ou en combinaison, a été confirmée dans des modèles in vitro (lignées cellulaires) et in ovo, ce dernier permettant d’évaluer l’efficacité de traitement sur des xénogreffes dérivées de cellules de patients (PDX).
En savoir plus :
Decombis S, Bellanger C, Le Bris Y, et al. CARD11 gain of function upregulates BCL2A1 and promotes resistance to targeted therapies combination in B-cell lymphoma. Blood Journal. 2023;blood.2023020211.
Contact
Laboratoire
Centre de recherche en cancérologie et immunologie intégrée Nantes-Angers - CRCI2NA (CNRS/Inserm/Nantes Université/Université d'Angers)
8 quai Moncousu,
44007 Nantes