L’organisation des architectes des cellules épithéliales
Les mécanismes d’organisation des cellules épithéliales sont très mal compris. Plusieurs protéines centrales dans ces processus ont été identifiées, mais les nombreuses interactions entre ces protéines ont rendu la compréhension de ces mécanismes difficile. Une approche par microscopie de super-résolution publiée dans eLife dévoile les interactions les plus pertinentes, simplifiant ainsi la vision passée. Ces découvertes permettront d’avancer plus rapidement sur la compréhension de l’organisation des cellules épithéliales et de la perte de cette dernière, à l’origine de 90% des cancers.
Les cellules épithéliales tapissent la surface de la plupart de nos organes avec une organisation très caractéristique. Les cellules sont serrées en une seule couche (dans les épithéliums simples) avec une surface tournée vers le monde extérieur (la surface apicale), tandis que la surface opposée est tournée vers les tissus internes (la membrane basale). Cet axe monde extérieur/tissus internes se reflète fortement dans l'organisation des cellules épithéliales : la composition de la membrane de la surface apicale est très différente de celle de la surface basale, et le transport, le cytosquelette et les jonctions cellulaires sont également fortement influencés par cet axe. En raison de cette organisation, les cellules sont qualifiées de polarisées dans l'axe apical-basal.
Plusieurs protéines ont été identifiées comme étant essentielles à l'acquisition et au maintien de la polarité, les protéines de polarité. Un obstacle majeur aujourd'hui est de comprendre le rôle de ces protéines à un niveau mécanistique, qui est à ce jour largement inconnu.
Si des procédures, principalement biochimiques, ont conduit à la description d’interactions potentielles entre les protéines de polarité, elles n’ont pas permis d’établir une hiérarchie d’importance parmi celles-ci. En outre, bien que l'on sache que la plupart de ces protéines se concentrent à proximité de la jonction serrée, jonction intercellulaire spécialisée déterminant la perméabilité de la couche de cellules épithéliales, la manière dont ces protéines s'organisent demeure à décrypter.
En utilisant la microscopie en super-résolution, les scientifiques ont observé comment ces protéines sont organisées dans la région de la jonction serrée des cellules intestinales de l'homme et de la souris. Tout d'abord, toutes les protéines de polarité s’organisent en amas moléculaires. Une des protéines a été trouvée spécifiquement au niveau de la jonction serrée (PAR3), tandis que les autres ont été observées plus près de la surface apicale. Ensuite, de manière surprenante, alors que la littérature prédit des dizaines de combinaisons potentielles de protéines, seuls deux couples de protéines se retrouvent dans les mêmes amas moléculaires (PAR6-aPKC et PALS1-PATJ). D'autres interactions pourraient être présentes, mais elles sont probablement transitoires. Finalement, PAR6-aPKC et PALS1-PATJ ont une organisation très particulière par rapport au cytosquelette d'actine : PALS1-PATJ se trouve à la base des microvillosités, des excroissances riches en actine à la surface apicale, tandis que PAR6-aPKC se trouve dans les microvillosités.
Cette étude propose un instantané de l'organisation de la polarité dans les cellules épithéliales intestinales qui appelle une définition nouvelle et plus dynamique des interactions entre les protéines de polarité et les protéines associées qui seront nécessaires pour découvrir la base mécanistique de la polarisation apico-basale des cellules.
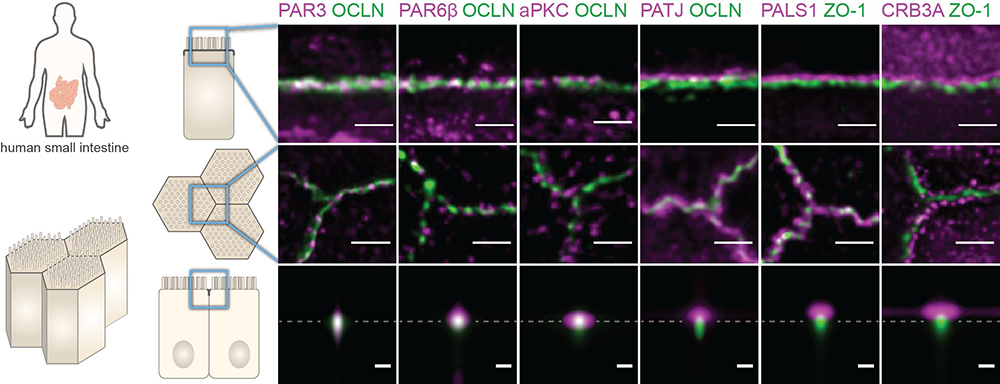
Figure : La microscopie de super-résolution STED permet de localiser précisément dans l’intestin humain les protéines de polarité (en vert) dans la région de la jonction serrée (en magenta).
Pour en savoir plus :
Super-resolution imaging uncovers the nanoscopic segregation of polarity proteins in epithelia
Mangeol, P., Massey-Harroche, D., Richard, F., Concordet, J. P., Lenne, P. F., & Le Bivic, A. (2022).
Elife, 11, e62087. DOI: 10.7554/eLife.62087
Contact
Laboratoire
Institut de Biologie du Développement de Marseille (IBDM) (CNRS/Aix-Marseille Université)