Les zones d’ancrage de la cellule, des pièges à récepteurs pour orchestrer les réponses biologiques
En combinant imageries dynamique et haute résolution, optogénétique et biomatériaux, des scientifiques ont montré que l’organisation spatiale des sous-unités de récepteurs de facteurs de croissance à la surface des cellules est un élément de réponse aux signaux physiques et biochimiques de la matrice extracellulaire. Cette découverte, publiée dans la revue The Journal of Cell Biology, identifie les zones d’ancrage à la matrice extracellulaire comme des pièges à récepteurs de facteurs de croissance pour coordonner les processus d'adhésion et de différenciation.
Les protéines de la matrice extracellulaire peuvent transmettre de multiples signaux aux cellules d'une manière régulée dans le temps et structurée dans l'espace. Par exemple, l’une des principales protéines de la matrice, la fibronectine, permet la liaison à des récepteurs adhésifs intégrines et à des facteurs de croissance. La proximité de ces sites d’interaction permet ainsi une juxtaposition fonctionnelle entre les intégrines et des récepteurs de facteurs de croissance. Des travaux précédents montraient que le facteur de croissance Bone Morphogenetic Protein 2 (BMP2), présenté par une matrice molle, était suffisant pour induire un étalement cellulaire. Cet étalement est associé à la formation des structures d’adhérence qui dépendent des récepteurs intégrines. Cependant, les mécanismes et les événements temporels permettant des réponses concertées entre récepteurs intégrines et récepteurs de facteurs de croissance restaient peu explorés. Les découvertes récentes ont permis de mettre en évidence la coopération entre les intégrines, qui sont des récepteurs relais de la mécanique tissulaire, et les récepteurs aux facteurs de croissance, qui sont de type tyrosine kinase (nommés ALK3 et BMPR2). Les récepteurs ALK3/BMPR2 sont décrits pour former des complexes à la surface des cellules quand ils se lient au facteur de croissance BMP2. Ce travail permet de montrer que de façon originale, le récepteur ALK3 existe sous forme de deux populations réparties à l'intérieur et à l'extérieur des sites d’ancrage à la matrice extracellulaire. Ainsi, une première population est associée à l’intégrine et une seconde forme un complexe avec le récepteur BMPR2. Le recrutement spatial et temporel de ALK3 à côté des intégrines, au sein même des sites d’adhérence, apparait être un aspect clé du contrôle de la signalisation induite par les BMPR. Cette répartition des deux populations ALK3 de part et d’autre des sites d’adhérence offre un éclairage nouveau sur la diversité des signaux cellulaires obtenus selon l'organisation spatiale des récepteurs. Ces interactions combinatoires présentent un intérêt physiopathologique pouvant expliquer les dualités fonctionnelles entre ALK3 (oncogène) et BMPR2 (suppresseur de tumeur) décrites dans la littérature.
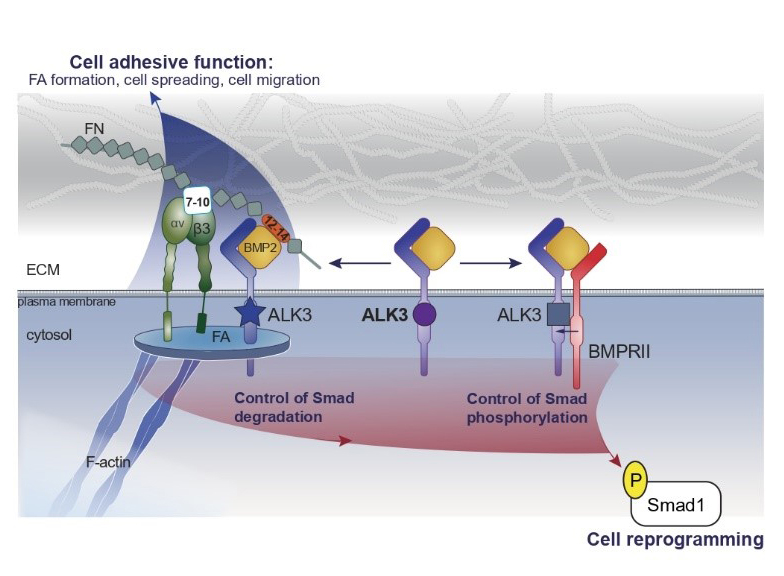
Figure : Représentation schématique de la répartition d'ALK3 à l'intérieur et à l'extérieur des systèmes d’ancrage des cellules à la matrice extracellulaire (connus sous le nom d’adhésions focales). Le BMP2 induit une redistribution d'ALK3 à la surface de la cellule dans différents domaines correspondant à deux populations confinées d'ALK3 : l'une est confinée dans des régions discrètes organisées par les intégrines (adhérences focales), dans lesquelles les sous-unités BMPRII sont exclues, et l'autre est immobilisée de manière homogène dans la membrane plasmique en dehors des adhérences focales, probablement par son association avec BMPRII. La fibronectine offre un site de liaison pour l’intégrine (domaine 7-10) et un site de liaison au BMP2 (domaine 12-14) favorisant la proximité entre ALK3 et l'intégrine β3 dans les adhérences focales. La signalisation Smad nécessite ALK3, BMPRII et les intégrines β3, tandis que les processus d'adhésion cellulaire (étalement et migration) reposent uniquement sur ALK3 et les intégrines β3.
Pour en savoir plus :
Integrin-based adhesion compartmentalizes ALK3 of the BMPRII to control cell adhesion and migration
Guevara-Garcia A, Fourel L, Bourrin-Reynard I, Sales A, Oddou C, Pezet M, Rossier O, Machillot P, Chaar L, Bouin AP, Giannone G, Destaing O, Picart C, Albiges-Rizo
Journal of Cell Biology, 7 octobre 2022. doi:10.1083/jcb.202107110
Contact
Laboratoire
Institut pour l’avancée des biosciences (CNRS/Inserm/Université Grenoble Alpes)
Allée des Alpes
Site Santé
38700 La Tronche