Les stimuli mécaniques générés par le flux sanguin régulent l'hématopoïèse chez la drosophile
Les cellules souches et progéniteurs hématopoïétiques (CSPHs) de la moelle osseuse des vertébrés donnent naissance aux cellules sanguines. Le maintien des CSPHs dépend de signaux provenant de leur microenvironnement tissulaire, appelé « niche ». Dans un article publié dans la revue PNAS, les scientifiques, ont montré, grâce au modèle drosophile comment les forces biomécaniques produites par le flux sanguin activent un canal ionique mécanodépendant et régule ainsi le contrôle de l’hématopoïèse.
L'hématopoïèse ou la production de cellules sanguines/immunitaires est un processus important chez tous les métazoaires et constitue une facette fondamentale de l'immunité.
L'importance des signaux biomécaniques dans la régulation des CSPHs, et les mécanismes moléculaires qui transduisent ces signaux mécaniques dans la régulation des gènes restent largement inconnus. Dans cette étude, les scientifiques ont découvert que, chez la drosophile, le stimulus mécanique, lié à la circulation du flux sanguin qui est généré lors des contractions du tube cardiaque, régule l'hématopoïèse. Ils ont également établi un réseau de régulation génique par lequel les forces biomécaniques régulent l’hématopoïèse. Le flux sanguin, en exerçant des forces biomécaniques sur les cellules de la niche vasculaire, active le canal ionique mécano sensible Piezo, ce qui conduit à réguler le niveau intracellulaire de Ca2+ dans ces cellules. Le Ca2+ régule l'activité de la voie de signalisation Notch qui inhibe la production du ligand de la voie des facteurs de croissance des fibroblastes (FGF) dans la niche vasculaire. La sécrétion de ce ligand par les cellules de la niche vasculaire active la signalisation FGF dans les progéniteurs hématopoïétiques et assure ainsi leur maintien.
Cette étude ouvre la voie vers une meilleure connaissance du rôle joué par les forces biomécaniques sur les cellules de la niche pour contrôler l’hématopoïèse. Le décryptage au niveau moléculaire des mécanismes impliqués chez la drosophile, et les parallèles avec le contrôle de l’hématopoïèse chez les mammifères, ouvrent de nouvelles perspectives de recherche fondamentale et clinique pour une meilleure compréhension du rôle des forces biomécaniques sur la biologie des cellules souches hématopoïétiques dans l'homéostasie, le vieillissement et le cancer.
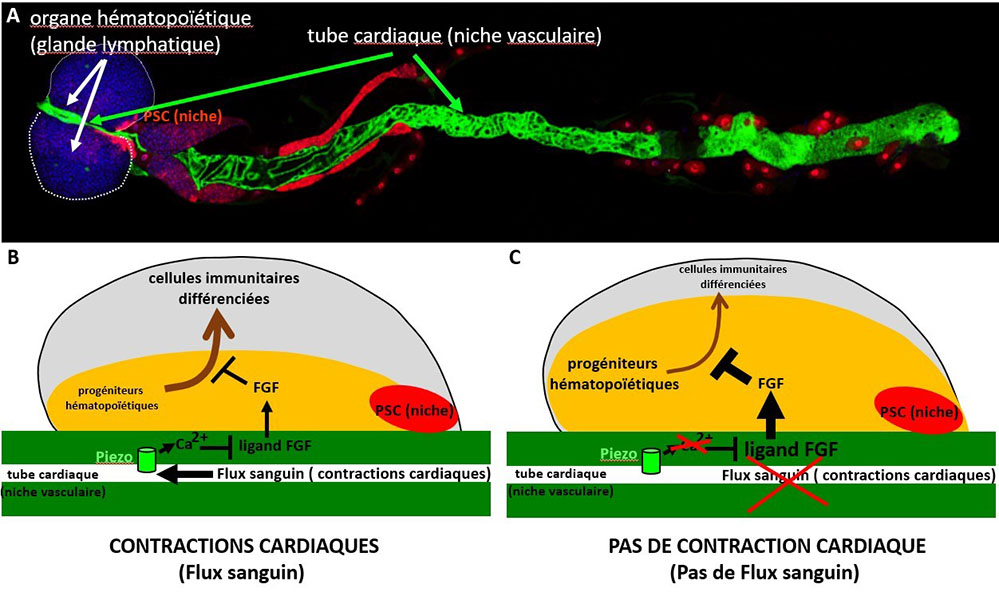
Figure : Le stimulus mécanique, résultant du flux sanguin qui est généré lors des contractions cardiaques, régule l’hématopoïèse dans la glande lymphatique qui est l’organe hématopoïétique de la drosophile.
A) La glande lymphatique et le tube cardiaque de larve de drosophile. Les 2 lobes composant la glande lymphatique sont entourés de pointillés blancs et indiqués par des flèches blanches. Le PSC (Postérieur Signalling Center), une des niches, est en rouge. La deuxième niche (niche vasculaire) qui correspond au tube cardiaque est marquée en vert.
B-C) Représentations schématiques de la glande lymphatique. Un seul lobe est présenté. Les progéniteurs et les cellules immunitaires différenciées sont respectivement en jaune et en gris. Les 2 niches, le PSC et le tube cardiaque (niche vasculaire) sont en rouge et vert, respectivement. La flèche marron indique la différenciation des cellules sanguines. (B) Le flux sanguin résultant des contractions cardiaques active Piezo dans les cellules cardiaques, entraînant une augmentation du calcium intracellulaire qui active la signalisation N, laquelle à son tour réprime l'expression du ligand de la voie de signalisation FGF dans les cellules de la niche vasculaire. Le ligand FGF produit par les cellules de la niche vasculaire active la voie FGF dans les progéniteurs, où elle est nécessaire pour leur maintien. (C) En absence de flux sanguin, les progéniteurs sont donc préférentiellement maintenus au détriment de leur différentiation.
Pour en savoir plus :
A mechanosensitive vascular niche for Drosophila hematopoiesis
Yushun Tian, Ismaël Morin-Poulard, Xiaohui Liu, Nathalie Vanzo and Michèle Crozatier
PNAS April 24, 2023. DOI : https://doi.org/10.1073/pnas.2217862120
Contact
Laboratoire
Unité de biologie moléculaire, cellulaire et du développement – MCD (CNRS/Université Paul Sabatier)
Centre de Biologie Intégrative – CBI
118 route de Narbonne, Bât 4R4,
31062 Toulouse Cedex 09
