Les rétrovirus endogènes : amis ou ennemis du système immunitaire ?
Les lymphocytes T jouent un rôle crucial dans la protection de l’organisme contre les agents pathogènes et les tumeurs. Les chercheurs ont montré que leur réponse aux signaux de l’environnement est contrôlée de l’intérieur par des rétrovirus endogènes. Ces génomes viraux, intégrés dans le génome, se comportent en effet comme des éléments régulateurs de gènes jouant un rôle clef dans les réponses T anti-virales ou anti-tumorales. Les auteurs ont mis en évidence que l’activité cis-régulatrice de ces séquences virales est régulée au niveau épigénétique par l’enzyme SETDB1. Cette étude est publiée dans la revue Immunity.
Les lymphocytes T sont des cellules du système immunitaire extrêmement efficaces pour protéger l'organisme contre des dangers exogènes, tels que des agents pathogènes, mais également endogènes comme les cellules cancéreuses. Leur efficacité résulte notamment de leur capacité à adapter finement leur phénotype et leur fonction au type de danger détecté par les cellules de l’immunité innée. Selon les signaux de l’environnement qu’elles intègrent, ces cellules activent en effet des programmes de développement distincts qui coordonnent leur différenciation en différentes sous-populations de cellules effectrices. Les lymphocytes Th1 sont par exemple nécessaires à l’éradication des tumeurs et au contrôle de nombreuses infections virales, tandis que les cellules Th2 sont impliquées dans la protection de l’organisme contre des parasites extracellulaires, et de façon délétère, dans les réponses allergiques. Identifier les mécanismes moléculaires qui contrôlent la programmation des lymphocytes T représente donc un intérêt clinique majeur.
Au cours des dix dernières années, des données de la littérature ont révélé que les programmes de développement qui définissent l’identité des différentes sous-populations de cellules T CD4 sont finement régulés au niveau de la chromatine. Dans ce contexte, les chercheurs se sont intéressés à une voie de répression épigénétique impliquant la triméthylation de l’histone H3 sur la lysine 9 (H3K9me3) par la lysine methyltransférase SETDB1. Si la marque épigénétique H3K9me3 avait déjà été impliquée dans la programmation des lymphocytes T en réponse aux signaux de l’environnement, personne n’avait encore analysé de façon systématique le rôle de SETDB1 dans la régulation de l’identité et des fonctions des cellules T CD4.
L’utilisation d’une lignée de souris transgénique dans laquelle SETDB1 n’est pas exprimée dans les lymphocytes T CD4 a permis de mettre en évidence que cette enzyme exerce un rétrocontrôle négatif sur les réponses Th1 et stabilise le phénotype des cellules Th2. En son absence, la détermination des cellules T naïves dans le lignage Th2 est en effet altérée ce qui permet aux cellules Th2 mutantes, contrairement à leurs contreparties sauvages phénotypiquement stables, de se trans-différencier vers un phénotype Th1. D’un point de vue mécanistique, les chercheurs ont montré que SETDB1 agit en ciblant un réseau de rétrovirus qualifiés d’endogènes, car intégrés et "silencieux" dans le génome des mammifères depuis plusieurs millions d’années. En l’absence de SETDB1, les séquences virales ne sont plus réprimées et peuvent alors de façon surprenante activer les gènes Th1 situés à proximité.
Ce travail met en évidence que SETDB1 régule un set de rétrovirus endogènes qui ont été cooptés par les cellules T en éléments cis-régulateurs du programme d’expression génique Th1. La molécule SETDB1 constitue donc une nouvelle cible thérapeutique potentielle dans de nombreuses situations
physiopathologiques.
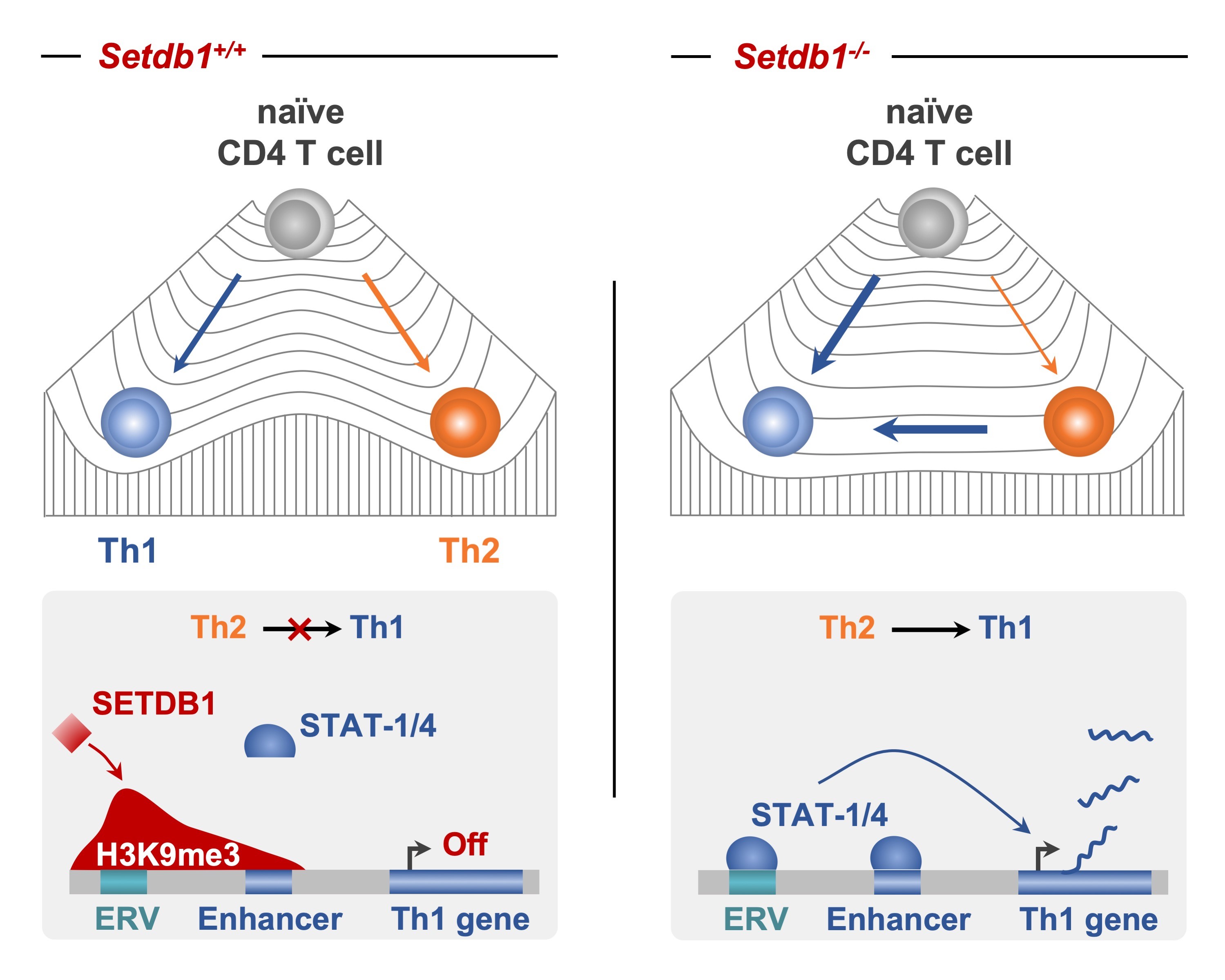
Figure : Dans les LT CD4, SETDB1 dépose la marque répressive H3K9me3 sur un répertoire de rétrovirus endogènes se comportant comme des éléments cis-régulateurs de gènes du programme Th1. Cette voie de répression épigénétique est ainsi nécessaire pour réguler l’amplitude des réponses Th1 ainsi que la stabilité des cellules Th2. En l’absence de SETDB1, les éléments cis-régulateurs dérivés des séquences virales, et les enhancers Th1 présents dans leur environnement, deviennent accessibles aux facteurs de transcription pro-Th1, notamment STAT1 et STAT4, qui peuvent alors mobiliser leurs gènes cibles. Au niveau cellulaire, cette dérégulation se traduit par une différenciation Th1 exacerbée et par la perte de stabilité des cellules Th2 qui peuvent alors se trans-différencier vers un phénotype Th1.
Adoue V, Binet B, Malbec A, Fourquet J, Romagnoli P, van Meerwijk JPM, Amigorena S, Joffre OP.
Immunity. 2019 Jan 31. pii: S1074-7613(19)30003-2. doi: 10.1016/j.immuni.2019.01.003.