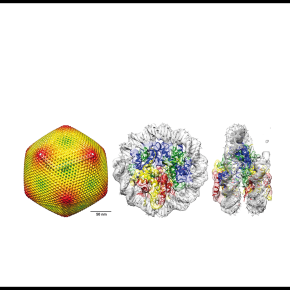
Les Marseilleviridae utilisent leurs propres histones pour compacter leur génome en nucléosomes
Alors qu'on pensait que l’organisation des génomes ADN en nucléosomes étaient réservé au monde cellulaire, l’étude des doublets d’histones de Melbournevirus, membre des Marseilleviridae, montre qu’elles sont essentielles au virus et permettent de former des nucléosomes pour compacter le génome viral dans les capsides. Cet article publié dans la revue Cell révèle la structure de ces nucléosomes, instables en dehors des capsides, qui dès l’initiation du cycle infectieux dans la cellule hôte vont se désorganiser pour permettre la transcription des gènes viraux précoces.
L'organisation de l'ADN génomique en nucléosomes a longtemps été considérée comme une caractéristique des cellules eucaryotes. Ce paradigme a été remis en cause par l'identification d’histones « minimalistes » chez les archées. L’organisation en nucléosomes restait néanmoins l’apanage du monde cellulaire.
La découverte d’homologues distants et fusionnés des quatre histones eucaryotes parmi les gènes des Marseilleviridae, une famille de virus géants qui infectent les amibes, a incité les scientifiques à explorer le rôle que ces protéines pouvaient jouer dans la structuration de ces génomes viraux d’environs 370 kb. Ils ont ainsi démontré que les histones virales, fusionnées en doublets, sont essentielles au processus d'infection, qu’elles se localisent dans les usines virales cytoplasmiques au cours de la réplication virale, et finissent massivement embarquées dans les particules matures.
A l’aide de la cryo-microscopie électronique les chercheurs ont pu déterminer la structure tridimensionnelle de ces premiers exemples de nucléosomes viraux et montré qu’ils présentaient de fortes ressemblances avec les nucléosomes eucaryotes, malgré des similarités de séquences très faibles (<30%).
Les connecteurs uniques qui relient les chaînes d'histones contribuent à l'instabilité observée des nucléosomes viraux, probablement nécessaire à la décompaction rapide du génome qui doit se faire dès l’initiation du cycle infectieux pour permettre à la RNA polymérase de réaliser la transcription des gènes viraux précoces.
D’une manière inattendue, ces résultats élargissent l’existence des nucléosomes en dehors du monde cellulaire, et suggèrent qu’un phénomène aussi essentiel et central que la compaction de l’ADN viral, n’est pas le résultat d’un processus évolutif commun à tous les virus géants infectant les amibes. Les nucleosomes font donc maintenant également partie du monde viral.
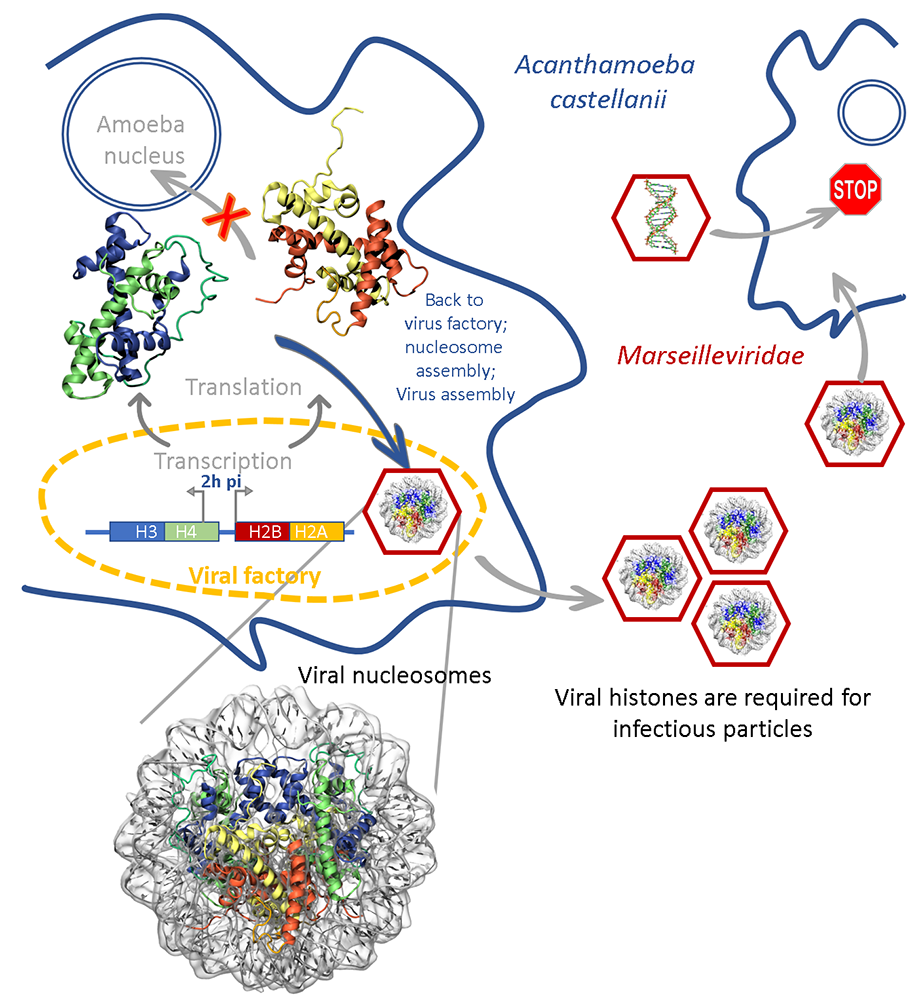
Figure : Les gènes des doublets d’histones virales (H3-H4 / H2B-H2A) sont transcrits à l’usine virale (viral factory) 2h post-infection, les protéines sont synthétisées dans le cytoplasme de la cellule hôte et recrutées à l’usine virale ou elles vont assembler le génome viral dans les capsides néosynthétisées sous forme de nucléosomes. Le KO des gènes des doublets d’histones va conduire à la production de virions qui seront non infectieux, sauf si l’on produit ces virions dans des cellules surexprimant le doublet d’histone manquant.
Pour en savoir plus :
Virus-encoded histone doublets are essential and form nucleosome-like structures
Yang Liu, Hugo Bisio, Chelsea Marie Toner, Sandra Jeudy, Nadege Philippe, Keda Zhou1, Samuel Bowerman, Alison White, Garrett Edwards, Chantal Abergel and Karolin Luger,
Cell 22 juillet 2021. DOI: https://doi.org/10.1016/j.cell.2021.06.032
Contact
laboratoire
Information génomique et structurale – IGS (CNRS-AMU)
Institut de Microbiologie de la Mediterrannée IMM
163 Avenue de Luminy - case 934, 13288 Marseille cedex 09 (France)
Howard Hughes Medical Institute, Jennie-Smoly-Caruthers Endowed Chair of Biochemistry,
University of Colorado at Boulder, 596 UCB Boulder,
CO United States 80309