LENOX, un ARN long non codant spécifique du mélanome, régule le métabolisme cellulaire et favorise la résistance aux inhibiteurs des MAP Kinases
Les mélanomes sont constitués de multiples types cellulaires avec des propriétés prolifératives et invasives différentes. Cette hétérogénéité tumorale représente une caractéristique clé des mélanomes qui complique le développement de traitements efficaces. Dans un article publié dans la revue Cancer Research, une revue de l’Association américaine pour la recherche sur le cancer, les scientifiques identifient un ARN long non-codant LINC00518/LENOX exprimé dans toutes les cellules de mélanome et nécessaire à leur survie et à la progression tumorale. Ils montrent que les mélanomes sont dépendants de ce facteur et mettent ainsi en lumière une nouvelle cible de traitement qui pourrait permettre de dépasser l’hétérogénéité tumorale.
Le mélanome est le cancer de la peau le plus malin. Malgré l'introduction de thérapies ciblées à base d'inhibiteurs de la forme oncogénique de BRAF (BRAFi), des MAP kinases (MAPKi) ou de l’immunothérapie, une fraction significative des patients est toujours considérée comme non-répondante ou développe une résistance. L'hétérogénéité du mélanome est un obstacle majeur à une thérapie efficace. De nombreux efforts ont été déployés pour comprendre les mécanismes moléculaires, tant génétiques qu'épigénétiques, à l'origine de la résistance aux MAPKi et à l’immunothérapie.
Les tumeurs de mélanome se composent d’une variété de types cellulaires caractérisés par des signatures d'expression génique spécifiques et des propriétés prolifératives, invasives et de résistance aux drogues différentes. Alors que les tumeurs naïves comprennent une grande majorité de cellules de mélanome de type mélanocytaire, les différentes thérapies entraînent l'apparition d'autres types cellulaires, notamment similaires aux cellules souches de la crête neurale ou proches de l’état indifférencié/mésenchymateux. Ces deux différents types cellulaires sont impliqués dans la maladie résiduelle minimale et l'acquisition de la résistance aux traitements. Il est donc important d’identifier des cibles communes à tous ces types cellulaires afin d’éradiquer les cellules de mélanome de façon efficace.
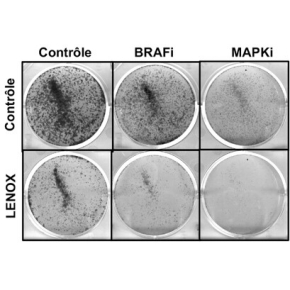
C’est dans ce cadre que les scientifiques ont identifié l’ARN long non-codant LENOX exprimé spécifiquement dans le mélanome et dont l’expression dans les mélanomes humains est associée à un mauvais pronostic. LENOX est essentiel à la viabilité des cellules de mélanome et au développement tumoral. Sur le plan mécanistique, LENOX interagit avec la GTPase RAP2C et promeut son interaction avec le régulateur de la fission mitochondriale DRP1. Cette interaction stimule la phosphorylation de la sérine 637 de DRP1 inhibant sa fonction et diminuant la fission mitochondriale avec comme conséquence des mitochondries allongées et une augmentation du métabolisme oxydatif. Ainsi, LENOX agit pour optimiser la fonction mitochondriale et la capacité de survie des cellules en conditions de stress pendant le développement et la progression du mélanome. De plus, LENOX facilite la transition métabolique de la glycolyse au métabolisme oxydatif et confère une résistance aux MAPKi. Par conséquent, l'inhibition de LENOX coopère avec les MAPKi pour éradiquer les cellules de mélanome.
Ainsi, les scientifiques montrent dans cette étude que les mélanomes sont dépendants de l’ARN long non-codant LENOX, qui optimise la fonction mitochondriale pendant le développement et la progression du mélanome. Une combinaison de l’inhibition de LENOX avec un traitement avec des MAPKi représente une nouvelle stratégie thérapeutique potentielle pour traiter les mélanomes.
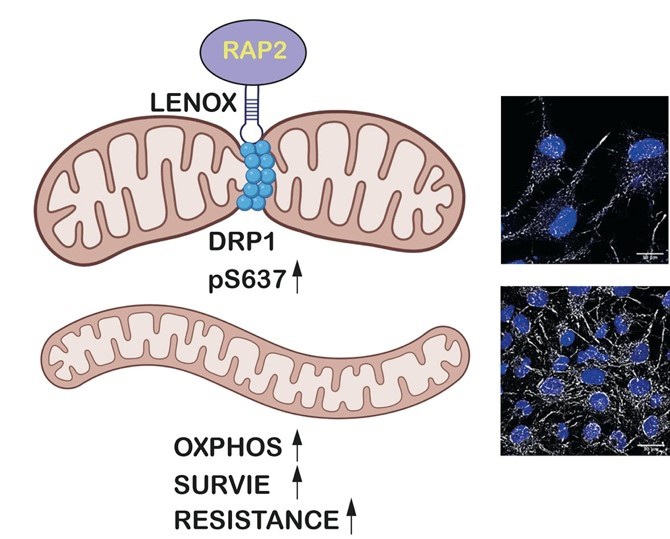
Légende : L’ARN long non-codant LENOX interagit avec la GTPase RAP2C permettant son interaction avec DRP1. Cette interaction stimule la phosphorylation de la sérine 637 de DRP1 inhibant sa fonction et diminuant la fission des mitochondries. Cette diminution de la fission permet une augmentation du métabolisme oxydatif (OXPHOS), de la survie de cellules de mélanome et d’une résistance aux traitements avec des MAPKi.
Pour en savoir plus :
The lncRNA LENOX interacts with RAP2C to regulate metabolism and promote resistance to MAPK inhibition in melanoma.
Giovanni Gambi, Gabrielle Mengus, Guillaume Davidson, Ewout Demesmaeker, Alessandro Cuomo, Tiziana Bonaldi, Vicky Katopodi, Gabriel G. Malouf, Eleonora Leucci and Irwin Davidson. Cancer Research, octobre 2022. https://doi.org/10.1158/0008-5472.CAN-22-0959
Contact
Laboratoire
Institut de génétique et de biologie moléculaire et cellulaire - IGBMC (CNRS/Inserm/Université de Strasbourg)
1 Rue Laurent Fries
67400 Illkirch-Graffenstaden