L’embryon met un string pour débuter son développement
L’embryon change de forme pendant son développement, un processus à l’origine de l’être vivant. Par des approches de microscopie à feuille de lumière couplée à des manipulations laser, d’analyse multidimensionnelle de morphométrie cellulaire et de simulation numérique les scientifiques ont pu découvrir un mécanisme basé sur la formation d’une ligne de tension mécanique le long de l’embryon responsable des changements morphologiques. Ces résultats sont publiés dans la revue Nature Communications.
La gastrulation est le processus par lequel le tissu primordial de l’embryon, le blastoderme, se remodèle : différents groupes de cellules se déplacent dans différentes parties de l’embryon pour, in fine, former au bon endroit les différents organes de l’animal. Un processus clef de la gastrulation est le repliement épithélial. Ce processus permet de déplacer un grand nombre de cellules à l’intérieur de l’embryon pour qu’elles puissent former les organes internes de l’animal. Les mécanismes responsables du repliement tissulaire ne sont pas encore bien compris. Dans cette étude, les scientifiques utilisent comme système-modèle l’embryon de drosophile (la mouche du vinaigre) et étudient le processus de repliement du tissu ventral qui forme le mésoderme de l’animal. La drosophile est en effet un système-modèle particulièrement avantageux car de nombreux outils génétiques sont disponibles.
Des études antérieures ont mené à l’hypothèse que l’initiation du repliement ventral chez l’embryon de drosophile résulte de la différence de tension mécanique entre les côtés apical et basal des cellules mésodermiques. Cette différence de tension peut en effet induire un moment de torsion du tissu. Néanmoins, cette nouvelle étude met en défaut cette hypothèse en montrant, par exemple, que des embryons mutants chez lesquels les cellules sont dépourvues du côté basal (donc ne peuvent pas générer de torsion) peuvent tout de même former un sillon ventral.
Grâce à des technologies de pointe de microscopie à feuille de lumière couplées à un laser infrarouge pulsé, à des techniques d’analyse d’image et de morphométrie en 4D ainsi que de modélisation mathématique, les scientifiques ont pu mettre en lumière un nouveau mécanisme basé sur la formation d’une ligne de tension le long de la surface ventrale de l’embryon. Cette ligne de tension mécanique résulte de la contraction d’un réseau supra-cellulaire du cytosquelette d’actomyosine couplé aux régions polaires antérieure et postérieure de l’embryon. Dans ce processus, les pôles de l’embryon ont une fonction de zones d’ancrage sur lesquelles le réseau contractile exerce une tension mécanique, produisant ainsi le sillon ventral. Ce processus, basé sur l’émergence d’une ligne de tension qui plie le tissu en formant un sillon, peut être intuitivement rapproché de la découpe d’un morceau de fromage par un « fil à fromage », un câble métallique mis sous tension.
Les simulations numériques de ce processus mécanique prédit une propagation bidirectionnelle du sillon ventral depuis la zone centrale vers les pôles antérieur et postérieur de l’embryon. Cette prédiction est validée expérimentalement. La propagation du repliement d’un tissu est un processus commun lors de la formation d’un tube épithélial (par exemple, pendant la formation du tube neuronal), processus qui peut se produire sous le contrôle d’un signal biochimique ou mécanique qui se propage dans l’espace. Les scientifiques démontrent aussi qu’en l’absence de propagation d’un tel signal, un sillon résultant de l’interaction des différents tissus épithéliaux à l’échelle embryonnaire peut tout de même se former et se propager.
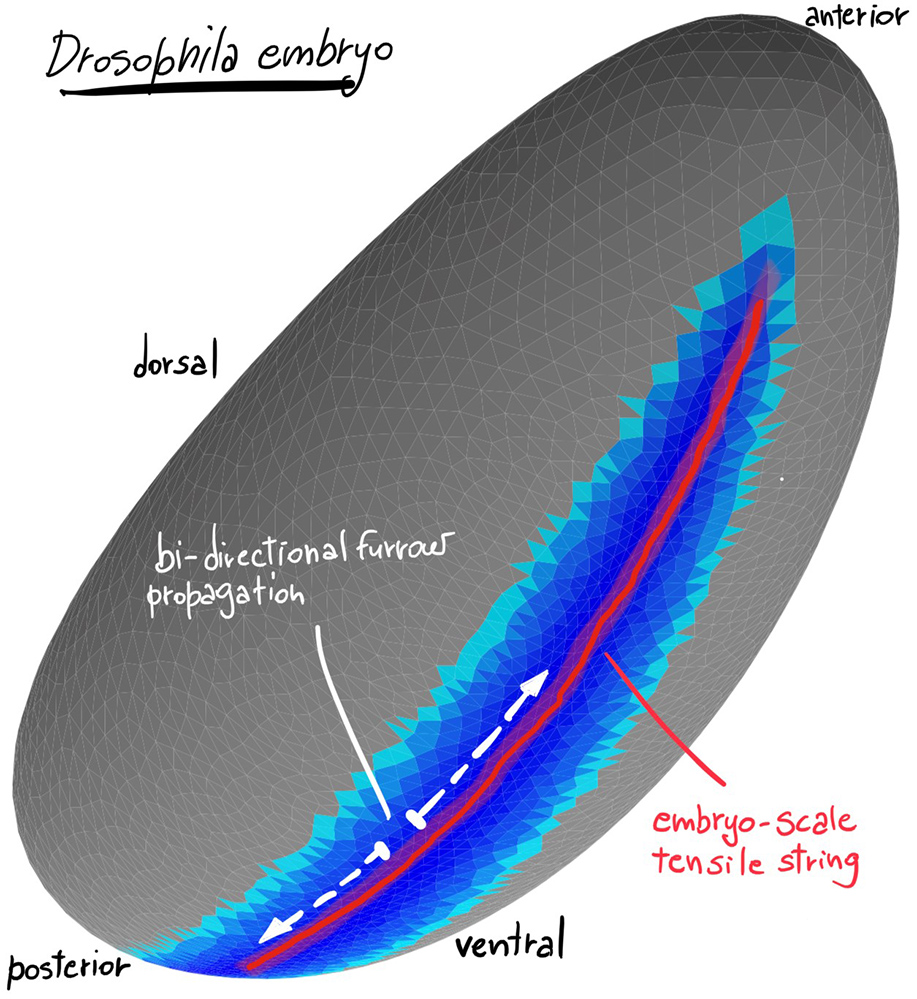
Figure : Représentation tridimensionnelle de la simulation numérique de l’embryon de drosophile pendant la formation du sillon ventral. La couleur bleue foncé indique une contraction accrue de la surface apicale. La ligne rouge indique la zone de plus grande tension mécanique où le sillon ventral se forme et se propage.
Pour en savoir plus :
Embryo-scale epithelial buckling forms a propagating furrow that initiates gastrulation.
Fierling J, John A, Delorme B, Torzynski A, Blanchard GB, Lye CM, Popkova A, Malandain G, Sanson B, Étienne J, Marmottant P, Quilliet C, Rauzi M.
Nat Communications 10 juin 2022 doi: 10.1038/s41467-022-30493-3.
Contact
Laboratoires
Institut de biologie Valrose - iBV (Université Côte d’Azur/CNRS/Inserm)
28 Avenue Valrose
06108 Nice
Laboratoire interdisciplinaire de physique - LIPHY (CNRS/Université Grenoble Alpes)
140 rue de la Physique
38042 Grenoble