Le vieillissement n’est pas un processus continu
Une méthode développée grâce au modèle drosophile, permet d’identifier les individus présentant un risque accru de mortalité naturelle. Dans un article publié dans la revue Aging Cell, les scientifiques ont étudié les gènes exprimés chez ces individus et identifié des marqueurs de fin de vie retrouvé chez cette population, quel que soit son âge chronologique. Enfin en agissant sur ces gènes, ils ont pu augmenter l’espérance de vie de plus de 10%.
Le vieillissement est un phénomène complexe aux définitions multiples et se manifestant de manières très diverses en fonction de l’organisme considéré, d’une mort rapide suivant la reproduction chez le saumon à une sénescence négligeable chez certains arbres ou encore certains arthropodes marins en passant par le cas qui nous intéresse le plus en tant qu’humains, caractérisé par une augmentation progressive du risque de mort naturelle à mesure que l’âge de l’individu augmente. L’organisme modèle, Drosophila melanogaster, la mouche du vinaigre utilisé dans cette étude a un vieillissement similaire au notre.
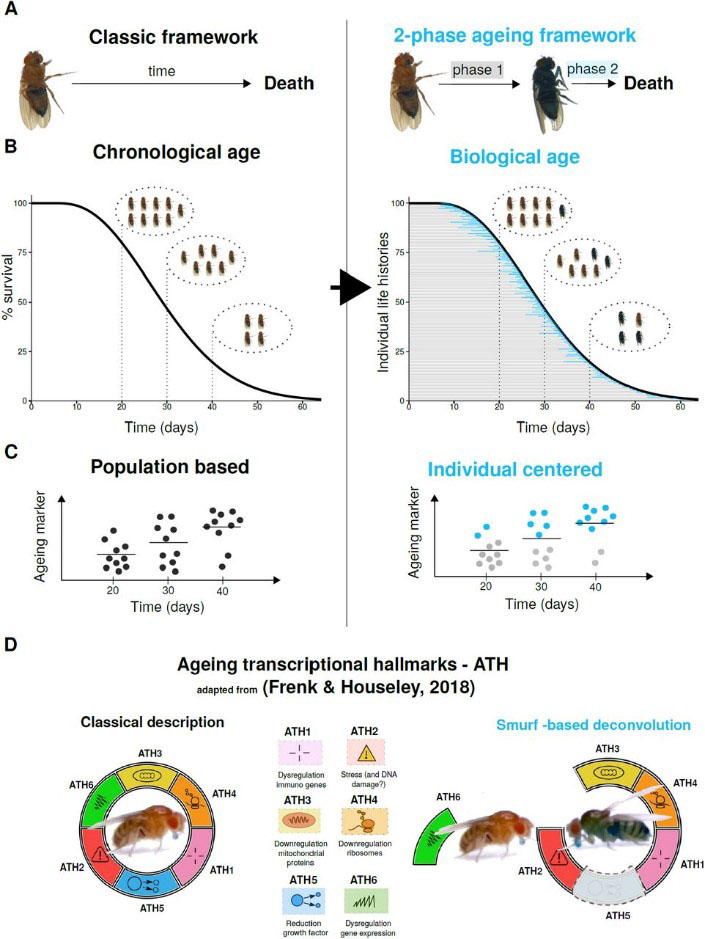
Au cours des 30 dernières années, les mécanismes moléculaires impliqués dans le vieillissement ont été caractérisés en partant de l’hypothèse que ce phénomène affecte les individus de manière progressive et continue. Ces approches ont permis d’identifier de nombreux gènes impliqués dans la régulation de la longévité et de définir un certain nombre de marqueurs du vieillissement, physiologiques ou moléculaires, affectés progressivement à mesure que les individus deviennent plus âgés. Précédemment à ces travaux, un phénotype appelé « Smurf », a été découvert chez la mouche, permettant d’identifier les individus sur le point de mourir de mort naturelle.
Dans cet article publié dans la revue Aging Cell, les scientifiques ont utilisé le phénotype Smurf comme un outil permettant de séparer, au sein d’une population, les individus proches de leur mort des individus en bonne santé, quel que soit l’âge chronologique des individus.
Grâce à cette approche, ils ont pu séparer les changements d’expression de gènes associés au passage du temps – l’âge chronologique – de ceux associée à la phase Smurf de fin de vie, c’est-à-dire d’âge biologique avancé. Pour quantifier ces effets, ils se sont concentrés sur six marqueurs transcriptionnels du vieillissement décrits précédemment. De manière surprenante, ces six marqueurs jusqu’alors décrits comme progressivement affectés au cours du vieillissement ne se retrouvent, pour cinq d’entre eux, que chez les individus dans l’état Smurf, c’est-à-dire lors d’une phase tardive du vieillissement et ce quel que soit leur âge chronologique. Un seul de ces marqueurs est significativement affecté par l’augmentation de l’âge chronologique, posant ainsi la question du lien causal qui le lie aux cinq autres marqueurs.
Les scientifiques disposent d’une boîte à outils très riche pour la drosophile, leur permettant de diminuer ou d’augmenter l’expression de n’importe quel gène de manière inductible.
En intervenant sur des gènes régulateurs susceptibles d’expliquer les modifications transcriptionnelles chez les Smurfs, avant que celles-ci ne se mettent en place, il a été possible d’augmenter l’espérance de vie des mouches entre 10 et 15%, en retardant l’entrée des individus dans la phase Smurf, c’est-à-dire en prolongeant leur durée de vie en bonne santé.
Ce travail permet donc les conclusions suivantes. Les marqueurs moléculaires du vieillissement sont plutôt des marqueurs de la fin de vie, une phase de risque de mort accru. Le facteur de risque principal associé à l’entrée dans cette phase semble être une augmentation du bruit d’expression génique, c’est-à-dire un contrôle moins précis, dont le rôle exact doit encore être déterminé. Enfin, en intervenant sur ces régulateurs potentiels de la transition Smurf de nouvelles cibles génétiques et/ou pharmacologiques ont été découverte, susceptibles de moduler la durée de vie en bonne santé. Le phénotype Smurf initialement découvert chez la drosophile est retrouvé dans d’autres modèles tel le, ver nématode, le poisson zèbre et la souris Les futures études devront donc prendre en considération, le fait que le vieillissement n’est pas un processus continu.
En savoir plus :
Smurfness-based two-phase model of ageing helps deconvolve the ageing transcriptional signature. / Flaminia Zane, Hayet Bouzid, Sofia Sosa Marmol, Savandara Besse, Julia Lisa Molina, Céline Cansell, Fanny Aprahamian, Sylvère Durand, Jessica Ayache, Christophe Antoniewski, Michael Rera / Aging Cell. doi: https://doi.org/10.1101/2022.11.22.517330
Contact
Laboratoire
Centre de recherche interdisciplinaire - CRI (Inserm/Université Paris Cité)
8 bis rue Charles V
75004 Paris
