Le transport subcellulaire au service de la mémoire
Dans une étude publiée dans Science Signaling, des scientifiques mettent en lumière un rôle inattendu d’une protéine de transport, l’importine β1, dans la mémoire. Connue jusqu’ici pour son implication dans le transport de protéines vers le noyau ou la régénération du nerf périphérique après lésion, cette protéine s’avère également essentielle au bon fonctionnement de la synapse, en particulier dans l’hippocampe, une région centrale pour la mémoire
Une protéine de transport au cœur de la mémoire.
Les neurones sont des cellules très allongées : leurs axones peuvent mesurer plusieurs millimètres, voire davantage. Or, pour transmettre efficacement les signaux nerveux, certaines protéines doivent être fabriquées directement au niveau des synapses, les zones de communication entre neurones.
Pour cela, les neurones transportent des ARN messagers (ARNm) le long de l’axone, puis les traduisent localement en protéines. Comment ces ARNm sont dirigés vers les bons endroits reste cependant en grande partie mystérieux.
Les scientifiques, dans un article publié dans la revue Science signaling, se sont intéressés à l’importine β1, une protéine de transport, en étudiant des souris génétiquement modifiées dont l’ARNm d’importine β1 a perdu une région essentielle appelée 3’UTR. Cette région agit comme une « étiquette d’adressage » permettant à l’ARNm d’atteindre l’axone. Résultat : ces souris présentent d’importants troubles de la mémoire spatiale et contextuelle, deux fonctions fortement dépendantes de l’hippocampe, une zone du cerveau impliqué dans la mémoire…
Un déficit présynaptique ciblé dans les fibres moussues de l’hippocampe.
En analysant l’activité électrique de neurones hippocampiques, les scientifiques ont observé un déficit très spécifique : une forme de plasticité à long terme d’origine présynaptique est altérée dans les fibres moussues, une voie neuronale particulière de l’hippocampe. À l’inverse, d’autres circuits, comme les collatérales de Schaffer, restent parfaitement fonctionnels.
Des expériences combinant culture de neurones, dispositifs microfluidiques, imagerie et analyses biochimiques montrent pourquoi : en l’absence de la région 3’UTR, l’ARNm de l’importine β1 reste bloqué dans le corps cellulaire du neurone (le soma) au lieu d’être transporté jusqu’aux terminaisons synaptiques. La protéine devient alors trop rare au niveau présynaptique, ce qui perturbe l’organisation et la signalisation des protéines impliquées dans la transmission du message nerveux.
La traduction locale comme mécanisme clé.
Pour aller plus loin, les chercheurs ont utilisé une technique innovante appelée RiboTag-Seq, qui permet d’identifier les ARNm effectivement en train d’être traduits en protéines dans une région précise de la synapse.
Ils ont ainsi montré que l’absence d’importine β1 dans l’axone réduit la traduction locale de gènes codant pour des éléments structuraux essentiels de la synapse.
Cette perturbation se traduit par une diminution du pool de vésicules synaptiques immédiatement mobilisables : ce sont les petites « poches » remplies de neurotransmetteurs, prêtes à être libérées pour transmettre un signal. Ce déficit a été confirmé par des observations en microscopie électronique et par des mesures électrophysiologiques fines.
Une nouvelle vision du rôle des protéines de transport.
Ces travaux changent notre regard sur l’importine β1 et, plus largement, sur les protéines dites « ménagères », longtemps considérées comme de simples transporteurs génériques. Ils montrent qu’en contrôlant la localisation et la traduction locale des ARNm, ces protéines peuvent jouer un rôle central dans la plasticité synaptique… et donc dans la mémoire.
À terme, cette découverte ouvre de nouvelles pistes pour comprendre comment des défauts subtils de transport et de synthèse locale des protéines pourraient contribuer à des troubles cognitifs ou neurologiques.
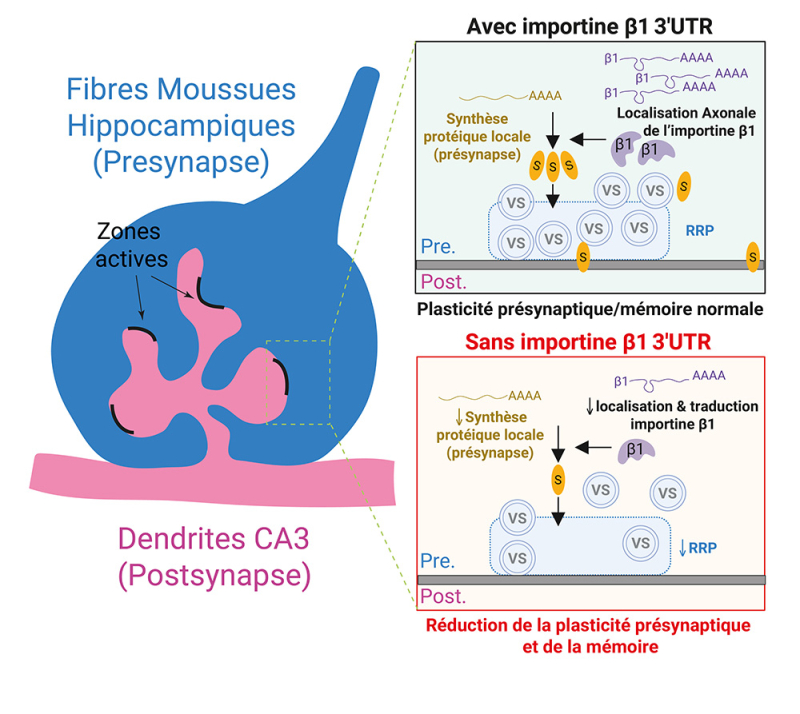
Figure : Mécanismes reliant l‘absence d'importine β1 axonale à une altération de la mémoire spatiale via un dysfonctionnement présynaptique. La réduction de la mémoire spatiale et contextuelle des souris importine β1 Δ3'UTR se traduit par une altération de la plasticité présynaptique des fibres moussues de l’hippocampe (en bleu sur le dessin à gauche) et une réduction du pool de vésicules synaptiques (VS) prêtes à être libérées (Readily Releasable Pool, RRP). Les résultats de l’étude montrent que ces dysfonctionnements synaptiques sont dus à une réduction de la synthèse locale de protéines synaptique (bulles jaunes/S) dans le bouton (présynaptique) des fibres moussues et d'une altération du phospho-protéome synaptique. Ainsi, l'importine β1 apparait comme un régulateur de la synthèse protéique locale des ARNm axonaux dans l'hippocampe.
En savoir plus : Philip A. Freund et al., Subcellular depletion of importin β1 impairs presynaptic local translation and spatial memory.Sci. Signal.19,eady2026(2026).DOI:10.1126/scisignal.ady2026
Contact
Laboratoire
Institut des Neurosciences Paris Saint-Pères - SPPIN (CNRS/Université Paris Cité)
45 rue des Saints-Pères
75006 Paris